GRUPOS IVA, VA, VIA, VIIA , DE LA
TABLA PERIÓDICA
ANA MARÍA GÓMEZ GAITÁN
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
11-1
IBAGUÉ-TOLIMA
2021
GRUPO IVA,VA,VIA,VIIA DE LA TABLA PERIODICA
ANA MARÍA GÓMEZ GAITÁN
DIANA FERNANDA JARAMILLO
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
11-1
IBAGUÉ-TOLIMA
2021
TABLA DE CONTENIDO
INTRODUCCIÓN
GRUPO IV
PROPIEDADES
FÍSICAS DEL GRUPO
PROPIEDADES
QUÍMICAS DEL GRUPO
DESCRIPCIÓN
DE LOS ELEMENTOS
GRUPO VA
PROPIEDADES
FÍSICAS DEL GRUPO
PROPIEDADES
QUÍMICAS DEL GRUPO
DESCRIPCIÓN
DE LOS ELEMENTOS
GRUPO VIA
PROPIEDADES
FÍSICAS DEL GRUPO
PROPIEDADES
QUÍMICAS DEL GRUPO
DESCRIPCIÓN
DE LOS ELEMENTOS
GRUPO VIIA
PROPIEDADES
FÍSICAS DEL GRUPO
PROPIEDADES
QUÍMICAS DEL GRUPO
DESCRIPCIÓN
DE LOS ELEMENTOS
INTRODUCCIÓN
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el carbono, elemento fundamental de la química orgánica. A su vez, el silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran importancia en la sociedad a partir del siglo XX, ya que es el elemento principal de los circuitos integrados.
PROPIEDADES QUÍMICA DEL GRUPO
- No reaccionan con el agua.
- El germanio, estaño y plomo son atacados por los ácidos.
- Son atacados por disoluciones alcalinas desprendiendo hidrógeno, a excepción del elemento carbono.
- Reaccionan con el oxígeno formando óxidos. Siendo los óxidos de carbono y silicio ácidos, el de estaño anfótero (es decir, que reacciona con ácidos y bases calientes) y lo mismo sucede con el plomo.
- Al formar hidruros presentan la habilidad de formar concatenación. La concatenación es la propiedad que poseen algunos elementos de unirse con otro átomo del mismo elemento para formar cadenas ya sea lineales ramificadas o cíclicas. Esta predisposición disminuye al descender en el grupo. La concatenación se le atribuye al elemento carbono, aunque también es un fenómeno suscitado en el silicio. Este fenómeno es la raíz de la química orgánica. Ubicación del grupo 14 en la tabla periódica.
El carbono es el 15.º elemento más abundante en la corteza terrestre y el cuarto elemento más abundante en el universo en masa. Es el segundo elemento más abundante en el cuerpo humano en masa (aproximadamente el 18,5%) después del oxígeno.
propiedades químicas
Alótropos
Isótopos
APLICACIONES
El carbono presenta múltiples aplicaciones siendo la más importante como componente de hidrocarburos, principalmente los combustibles fósiles, es decir, petróleo y gas natural. Del petróleo se pueden obtener, después del refino en plantas petroquímicas, los siguientes derivados:
Gases: Empleados para combustible doméstico y de transporte.
Gasolinas: Usados como combustible para motores industriales y automóviles.
Querosén: Combustible de aviación.
Gas-oil: Usado como combustible en motores diesel.
Aceites lubricantes: Empleados en la industria química como engrasado de máquinas o explosivos.
Asfaltos: Para la pavimentación de carreteras.
Parafinas y carbón de coque: Empleados en altos hornos.
Vaselina: Utilizada para pomadas y ungüentos.
Otros subproductos son: alcoholes y bencenos utilizados en la elaboración de fibras textiles, plásticos, lacas, colorantes y disolventes.
Entre otros usos, el carbono también se emplea en aleaciones para obtener acero. El acero es una mezcla de hierro con una cantidad de carbono variable entre el 0,03 % y el 2,14 % en masa de su composición, dependiendo del grado.
En el campo de la medicina se utiliza las pastillas de carbón activado para absorber las toxinas del sistema digestivo en caso de intoxicación, tanto en personas como animales. También se usa como medicina para los problemas digestivos o de flatulencia. Dentro de otras aplicaciones tenemos que se emplea en la extracción de metales, la esterilización de agua potable, en el tratamiento de aguas residuales, purificación de jarabe de azúcar y de glicerina, en mascarillas antigás, en filtros purificadores y en controladores de emisiones de coches, entre otros.
Características
Sus propiedades son intermedias entre las del carbono y el germanio. En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95 % de las longitudes de ondade la radiación infrarroja.
- Como material refractario, se usa en cerámicas, vidriados y esmaltados.
- Como elemento fertilizante en forma de mineral primario rico en silicio, para la agricultura.
- Como elemento de aleación en fundiciones.
- Fabricación de vidrio para ventanas y aislantes.
- El carburo de silicio es uno de los abrasivos más importantes.
- Se usa en láseres para obtener una luz con una longitud de onda de 456 nm.
- La silicona se usa en medicina en implantes de seno y lentes de contacto.
- Fibra óptica.
- Electrónica: radares y amplificadores de guitarras eléctricas usados para recrear sonidos de la primera época del rock and roll; aleaciones de Germanato de Silicio (SiGe) en circuitos integrados de alta velocidad. También se utilizan compuestos sandwich Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).
- Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos.
- Lentes, con alto índice de refracción, de ángulo ancho y para microscopios.
- En joyería se usa la aleación Au con 12% de germanio.
- Como elemento endurecedor del aluminio, magnesio y estaño.
- Quimioterapia.
- El tetracloruro de germanio es un ácido de Lewis y se usa como catalizador en la síntesis de polímeros (PET).

QUIMIOTERÁPIA
HISTORIA:
Las propiedades del germanio (del latín Germania, Alemania) fueron predichas en 1871 por Mendeleyev en función de su posición en la tabla periódica, elemento al que llamó eka-silicio. El alemán Clemens Winkler demostró en 1886 la existencia de este elemento, descubrimiento que sirvió para confirmar la validez de la tabla periódica, habida cuenta de las similitudes entre las propiedades predichas.
 El germanio se encuentra más comúnmente en la naturaleza como un contaminante de diversos minerales y es obtenido de los residuos de cadmio remanentes del procesado de los minerales de zinc. Las investigaciones toxicológicas han demostrado que el germanio no se localiza en ningún tejido dado que se excreta rápidamente principalmente por la orina. Las dosis excesivas de germanio lesionan los lechos capilares de los pulmones. Produce una diarrea muy marcada que provoca una deshidratación, hemoconcentración, caída de la presión arterial e hipotermia.
El germanio se encuentra más comúnmente en la naturaleza como un contaminante de diversos minerales y es obtenido de los residuos de cadmio remanentes del procesado de los minerales de zinc. Las investigaciones toxicológicas han demostrado que el germanio no se localiza en ningún tejido dado que se excreta rápidamente principalmente por la orina. Las dosis excesivas de germanio lesionan los lechos capilares de los pulmones. Produce una diarrea muy marcada que provoca una deshidratación, hemoconcentración, caída de la presión arterial e hipotermia. |
| plaga de Estaño |
Es un metal blanco, maleable, que se oxida fácilmente, a temperatura ambiente, cambiando de color a un gris más opaco, y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Al doblar una barra de este metal se produce un sonido característico llamado grito del estaño, producido por la fricción de los cristales que la componen. Una de sus características más llamativas es que bajo determinadas condiciones sufre la peste del estaño. Por debajo de los -18°C empieza a descomponerse y a convertirse en un polvo gris; a este proceso se lo conoce como peste del estaño. El estaño puro tiene dos variantes alotrópicas: el estaño gris, polvo no metálico, semiconductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco. El estaño blanco, el normal, metálico, conductor eléctrico, de estructura tetragonal y estable a temperaturas por encima de 13,2 °C.
- Se usa como protector del oro, del acero y de diversos metales usados en la fabricación de latas de conserva.
- También se usa para disminuir la fragilidad del vidrio.
- Los compuestos de estaño se usan para fungicidas, tintes, dentífricos y pigmentos.
- Se usa para realizar bronce, aleación de estaño y cobre.
- Se usa para la soldadura blanda, aleado con plomo.
- Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales.
- Tiene utilidad en etiquetas.
- Recubrimiento de acero.
- Se usa como material de aporte en soldadura blanda con cautín, bien puro o aleado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos.
- El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un o pacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.
- Es usado también en el sobre taponado de botellas de vino, en forma de cápsula. Su uso se extendió tras la prohibición del uso del plomo en la industria alimentaria. España es uno de los mayores fabricantes de cápsulas de estaño.
Efectos sobre el ser humano
- La ingestión de alimentos o bebidas que se encuentran envasados en latas hechas con estaño, aunque la mayoría de las que se encuentran actualmente en el mercado están protegidas mediante una laca protectora.
- Ingestión de pescados o mariscos que procedan de aguas contaminadas con este metal.
- Contacto con productos domésticos que contengan compuestos de estaño, como algunos plásticos tales como el PVC.
- Respirar aire que contenga vapores de estaño o polvo de estaño.
En la historia
En la actualidad
- El blanco de plomo (conocido también como albayalde) 2PbCO3.Pb(OH)2
- Sulfato básico de plomo
- El tetróxido de plomo también conocido como minio.
- Cromatos de plomo.
- El silicatoeno de plomo (más conocido en la industria de los aceros blandos)
Origen de la contaminación por plomo
Efectos en el organismo
- Perturbación de la biosíntesis de hemoglobina y subsecuentemente anemia
- Incremento de la presión sanguínea
- Daño a los riñones
- Aborto espontáneo
- Perturbación del sistema nervioso
- Daño al cerebro
- Disminución de la fertilidad del hombre a través del daño en el esperma
- Disminución de las habilidades de aprendizaje de los niños
- Perturbación en el comportamiento de los niños, como es agresión, comportamiento impulsivo e hipersensibilidad.
Plomo en el medio ambiente
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
PROPIEDADES FÍSICAS DEL GRUPO DEL GRUPO
El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.
Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
- El arsénico gris metálico: es la forma más estable de las tres y es un buen conductor del calor pero bastante malo conductor de electricidad.
- El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
- El arsénico negro: Presenta propiedades intermedias entre las formas anteriores.
- De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
- Antimonio puro gris plateado
- Antimonio blanco azulado: es su forma más estable y metálica
- Antimonio negro: Inestable y no metálico
- Antimonio amarillo: Inestable y no metálico
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
.
- En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
- En la elaboración de acero inoxidable.
- Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves.
- Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza.
- En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo.
- En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico.
- En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.
ABUNDANCIA Y OBTENCION
- Tiene reacciones con la hemoglobina en la sangre, causando una disminución en la capacidad de transporte de oxígeno por la sangre. (nitrito)
- Provoca la disminución del funcionamiento de la glándula tiroidea. (nitrato)
- Ocasiona un bajo almacenamiento de la vitamina A. (nitrato)
- Favorece la producción de nitrosaminas, las cuales son conocidas como una de las causas más comunes de cáncer. (nitratos y nitritos).
El fósforo como molécula de Pi («fosfato inorgánico»), forma parte de las moléculas de ADN y ARN, las células lo utilizan para almacenar y transportar la energía mediante el adenosín trifosfato (ATP). Además, la adición y eliminación de grupos fosfato a las proteínas, fosforilación y desfosforilación, respectivamente, es el mecanismo principal para regular la actividad de proteínas intracelulares, y de ese modo el metabolismo de las células eucariotas tales como los espermatozoides.
Es un ciclo sedimentario, su reservorio es la corteza terrestre. El elemento se almacena en rocas fosfatadas y a medida que estas son erosionadas se van liberando compuestos fosfatados hacia el suelo y el agua. Luego son absorbidos por las plantas, a través de las raíces, incorporándose a los componentes vivos del sistema, a medida que pasan por los distintos niveles tróficos. Una vez que los organismos (plantas o animales) mueren, se descomponen y se libera el fósforo contenido en la materia orgánica. Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
- El fósforo es un componente esencial de los organismos.
- Forma parte de los ácidos nucleicos (ADN y ARN).
- Forma parte de los huesos y dientes de los animales.
- En las plantas en una porción de 0,2 % y en los animales hasta el 1 % de su masa es fósforo.
- El fósforo común es un sólido.
- De color blanco, pero puro es incoloro.
- Un característico olor desagradable.
- Es un no metal.
- Emite luz por fosforescencia.Existen varias formas alotrópicas del fósforo, siendo las más comunes el fósforo blanco y el rojo; ambos forman estructuras tetraédricas de cuatro átomos. El fósforo blanco, extremadamente tóxico e inflamable presenta dos formas, alfa y beta, con una temperatura de transición de −3,8 °C; expuesto a la luz solar o al calor (300 °C) se transforma en fósforo rojo en reacción exotérmica. Éste es más estable y menos volátil y tóxico que el blanco y es el que se encuentra normalmente en los laboratorios y con el que se fabrican las cerillas. El fósforo negro presenta una estructura similar al grafito y conduce la electricidad, es el más denso que los otros dos estados y no se inflama.
ABUNDANCIA Y OBTENCIÓN
- Naturales como la meteorización, actividad biológica, emisiones volcánicas
- Antropogénicos como la actividad minera, uso de combustibles fósiles, uso de pesticidas, herbicidas, etc.
El arsénico se presenta en tres estados alotrópicos, gris o metálico, amarillo y negro.
El arsénico gris metálico (forma α) es la forma estable en condiciones normales y tiene estructura
romboédrica, es un buen conductor del calor pero pobre conductor eléctrico, su
densidad es de 5,73 g/cm³, es deleznable y pierde el lustre metálico
expuesto al aire
El arsénico
“amarillo” (forma γ) se obtiene cuando el vapor de
arsénico se enfría muy rápidamente. Es extremadamente volátil y más reactivo
que el arsénico metálico y presenta fosforescencia a temperatura ambiente. El gas
está constituido por moléculas tetraédricas de As4 de forma análoga al fósforo y el sólido formado por la condensación
del gas tiene estructura cúbica, es de textura jabonosa y tiene una densidad
aproximada de 1,97 g/cm³. Expuesto a la luz o al calor revierte a la forma
estable (gris). También se denomina arsénico amarillo al oropimente, mineral de
trisulfuro de arsénico.
El arsénico “negro” (forma β) de estructura hexagonal y densidad
4,7 g/cm³, tiene propiedades intermedias entre las formas alotrópicas
descritas y se obtiene en la descomposición térmica de la arcina o bien enfriando lentamente el vapor de arsénico.
Todas las
formas alotrópicas excepto la gris carecen de lustre metálico y tienen muy
baja conductividad
eléctrica por lo que el elemento se comportará como metal o no metal en función, básicamente, de su estado de
agregación.También vea metal pesado.
A presión
atmosférica el arsénico sublima a 613 °C, y a 400 °C arde con llama
blanca formando el sesquióxido As4O6. Reacciona violentamente con el cloro y se combina, al calentarse, con la mayoría de los
metales para formar el arseniuro correspondiente y con el azufre. No reacciona con el ácido clorhídrico en ausencia de oxígeno, pero sí con el nítrico caliente, sea diluido o
concentrado y otros oxidantes como el peróxido de hidrógeno, ácido perclórico,
etc. Es insoluble en agua pero muchos de sus compuestos lo son.
Es un elemento químico
esencial para la vida aunque tanto el arsénico como sus compuestos son
extremadamente venenosos.
Se encuentra en
el 2.º grupo analítico de cationes; precipita con H2S de color amarillo.
APLICACIONES
En uso
·
Preservante de la madera (arseniato de plomo y cromo), uso que representa, según
algunas estimaciones, cerca del 70 % del consumo mundial de arsénico.
·
El arseniuro de galio es un importante material semiconductor empleado en circuitos integrados más rápidos, y caros, que los
de silicio. También se usa en la construcción de diodos láser y LED.
·
Aditivo en aleaciones de plomo y latones.
·
Insecticida (arseniato de plomo), herbicidas (arsenito de sodio) y venenos: a
principios del siglo XX se usaban compuestos inorgánicos pero su uso ha
desaparecido prácticamente en beneficio de compuestos orgánicos (derivados
metílicos). Sin embargo, esas aplicaciones están
declinando.
·
El disulfuro de arsénico se usa como pigmento y en
pirotecnia.
· Decolorante en la fabricación del vidrio (trióxido de arsénico).
En desuso
·
Históricamente el arsénico se ha empleado con fines
terapéuticos prácticamente abandonados por la medicina occidental aunque recientemente se ha renovado el interés por su uso
como demuestra el caso del trióxido de arsénico para el tratamiento de
pacientes con leucemia
promielocítica aguda.
·
Como elemento fertilizante en forma de mineral primario
rico, para la agricultura.
·
A lo largo de la historia el arsénico y sus compuestos
han sido utilizados con fines homicidas, fundamentalmente en forma de anhídrido
arsenioso (polvo blanco, insípido e inodoro llamado rey de los venenos).
·
Elaboración de insecticidas, herbicidas, raticidas,
fungicidas, etc, aunque cada vez se utiliza menos con estos fines.
HISTORIA
ABUNDANCIA Y OBTENCIÓN
Estudios arqueológicos e históricos indican que el antimonio y sus sulfuros han sido usados por los humanos al menos durante los últimos 6 milenios. En la antigüedad fue el principal ingrediente del “kohl”, una pasta negra usada por los egipcios, entre otros, como maquillaje para los ojos. Los babilonios conocían la forma de obtener antimonio de sus compuestos y lo usaban como ornamento para vasijas.El alquimista Basil Valentine (1565-1624), presentado a veces como el descubridor del antimonio, fue el primero en describir la extracción de antimonio de sus compuestosTras la invención de la imprenta en el siglo XVI el antimonio fue usado como aleante para los sellos tipográficos. Al enfriar, el antimonio líquido tiene la propiedad excepcional de expandirse mientras se solidifica. De este modo consigue rellenar las grietas de los moldes, por lo que las aristas de las piezas que se obtienen son muy afiladas. En el siglo XIX su aleación con zinc (metal inglés) fue utilizada en los cubiertos, palmatorias y candelabros.Tras el invento del acumulador eléctrico se comprobó que el uso de la aleación de plomo y antimonio hacía durar mucho más a los mismos. Durante la Primera Guerra Mundial se alcanzó un máximo de producción, debido a su uso armamentístico, ya que este semimetal aumenta mucho la dureza y la fuerza mecánica del plomo y del estaño. Con el desarrollo de la industria automovilística el uso del antimonio ha ido aumentando año tras año, aunque los niveles de la Primera Guerra Mundial no se volvieron a alcanzar hasta los años 1990.
APLICACIONES
El antimonio tiene una creciente importancia en la industria de semiconductores en la producción de diodos, detectores infrarrojos y dispositivos de efecto Hall.Usado en aleaciones, este semimetal incrementa mucho la dureza y resistencia a esfuerzos mecánicos de la aleación. También se emplea en distintas aleaciones como peltre, metal antifricción (aleado con estaño).Algunas aplicaciones más específicas:- Baterías y acumuladores
- Tipos de imprenta
- Recubrimiento de cables
- Cojinetes y rodamientos
Compuestos de antimonio en forma de óxidos, sulfuros, antimoniatos y halogenuros de antimonio se emplean en la fabricación de materiales resistentes al fuego, esmaltes, vidrios, pinturas y cerámicas. El trióxido de antimonio es el más importante y se usa principalmente como retardante de llama, comprenden distintos mercados como ropa, juguetes, o cubiertas de asientos.
- Baterías y acumuladores
- Tipos de imprenta
- Recubrimiento de cables
- Cojinetes y rodamientos
Usos metálicos
Desde que la batería eléctrica de plomo y ácido fue desarrollada en el siglo XIX, ha sido en gran medida la batería secundaria (o recargable) más importante por todo el mundo. Se utilizan en vehículos de motor, o como baterías industriales.
El antimonio es un componente menor pero importante de muchas soldaduras suaves. Estas soldaduras pueden contener entre 0,5 y 3% de antimonio.. El antimonio se ha utilizado como un endurecedor para el plomo usado en la munición.En los Estados Unidos su uso se confina en gran parte a la fabricación de balas y perdigones. Las aleaciones de plomo que contienen cerca del 2 al 8% de antimonio son resistentes al uso atmosférico y la corrosión por lo que son utilizadas en la construcción de canales y barreras de la humedad. En la industria química, las aleaciones que contienen a partir 4 a 15 % de antimonio proporcionan la protección contra varios estados líquidos de los productos químicos, especialmente del ácido sulfúrico o del azufre. Aleado con bismuto, plomo y estaño, el antimonio es un componente de algunas de las aleaciones fusibles usadas en dispositivos de seguridad de fuego.
Usos no metálicos
La punta de los fósforos de seguridad contiene trisulfuro de antimonio. La combustión es una reacción exotérmica mantenida por los radicales libres internamente generados y el calor radiante. Los retardadores con halógeno de la llama actúan interfiriendo con el mecanismo de cadena radical en la fase de gas (la llama). Muchos plásticos comunes son susceptibles a la degradación por el calor y la luz ultravioleta (UV) . El antimonio ha sido utilizado desde los años 1950 como estabilizador de calor eficaces para el PVC, especialmente en las formas rígidas del plástico..Los pigmentos conductores de la electricidad del óxido de estaño (SnO) con antimonio se han introducido en años recientes para incorporarlos en las capas plásticas que protegen las computadoras y otros componentes electrónicos contra la electricidad estática.El antimonio fue utilizado en medicina, por su buenas cualidades expectorantes, eméticas y purgantes. Y se llegaron a escribir tratados sobre sus cualidades médicas. Hasta que se decidió declararlo veneno, de forma oficial, el 3 de agosto de 1866. En forma de sales de antimonio Sb(OH)2Cl (Sbv) o como antimonio pentavalente, aún se menciona como tratamiento inicial contra leishmaniasis.
ANTIMONIO Y AMBIENTE
El antimonio es liberado al ambiente desde fuentes naturales e industriales. Puede permanecer en el aire adherido a partículas muy pequeñas por muchos días. La mayoría del antimonio en el aire se deposita en el suelo, en donde se adhiere firmemente a partículas que contienen hierro, manganeso o aluminio. Altos niveles de antimonio en el aire que respiramos por períodos muy largos pueden ocasionar irritación de los ojos y los pulmones y causar problemas respiratorios, del corazón y del estómago.El límite de exposición ocupacional es 0,5 mg de antimonio por m de aire por un día laborable de 8 h.En el aire urbano, la principal fuente de antimonio es la combustión de combustibles fósiles en vehículos automotores, centrales eléctricas e incineradores.Se cree que el país que más antimonio lanza a la atmósfera es China, debido a gran uso que se hace de este elemento en ese país, ya que posee las principales minas de antimonio del mundo. Sin embargo, debido al régimen político no se tienen datos.
ABUNDANCIA Y OBTENCIÓN
El antimonio se encuentra en la naturaleza en numerosos minerales, aunque es un elemento poco abundante. Pero es posible encontrarlo libre, normalmente está en forma de sulfuros; la principal mena de antimonio es la antimonita (también llamada estibina), Sb2S3.Mediante el tostado del sulfuro de antimonio se obtiene óxido de antimonio (III), Sb2O3, que se puede reducir con coque para la obtención de antimonio.- 2Sb2O3 + 3C → 4Sb + 3CO2
También se puede obtener por reducción directa del sulfuro, por ejemplo con chatarra de hierro:- Sb2S3 + 3Fe → 2Sb + 3FeS
- COMPUESTOS
- 2Sb2O3 + 3C → 4Sb + 3CO2
- Sb2S3 + 3Fe → 2Sb + 3FeS
- COMPUESTOS
Sus estados de oxidación más comunes son el 3 y el 5.Los términos antimonio crudo y crudum se aplican al mineral que contiene más de 90 por ciento de antimonio, y al mineral del sulfuro licuado, que es esencialmente una mezcla del antimonio-sulfuro que contiene 70 por ciento o más antimonio. El metal refinado del antimonio es la forma común estable de antimonio.El antimonio amarillo o alfa-antimonio se produce por la acción de ozono en SbH3 líquido, -90 °C. Es amorfo y poco soluble en disulfuro de carbono. El antimonio amarillo es muy inestable y se transforma fácilmente a temperaturas superiores -90 °C en antimonio negro, que también puede formarse directamente a partir de SbH3líquido y oxígeno a -40 °C. El antimonio negro se oxida espontáneamente en aire y se convierte en el antimonio romboédrico ordinario o beta-antimonio. La cuarta forma alotrópica del antimonio es el antimonio explosivo, que se forma a partir de la electrólisis del cloruro de antimonio.Esta forma se transforma a 475 K en la forma alotrópica más común produciendo una explosión. Hay estudios que intentan demostrar que el antimonio amarillo es en realidad antimonio impuro y no es una forma alotrópica verdadera del antimonio.El antimonio forma un número muy grande de compuestos inorgánicos. Los sulfuros predominan en naturaleza y están disponibles para el comercio como minerales procesados del antimonio. En términos de las cantidades producidas, el compuesto sintético más importante del antimonio en gran medida es el trióxido (Sb2O3), que es utilizado por sí mismo para algunas aplicaciones.Otros compuestos usados en cantidades substanciales son el pentóxido (Sb2O5), el trisulfuro (Sb2S3) y el pentasulfuro (Sb2S5). Estos compuestos se utilizan como los retardadores de la llama, en los pigmentos, estabilizadores del calor y de la radiación en los plásticos y de catalizadores.Se conocen todos sus trihalogenuros, SbX3, y el pentafluoruro y pentacloruro, SbX5. El trifluoruro se emplea como fluorante. El pentafluoruro junto con HSO3F forma un sistema SbF5-FSO3H con propiedades de superácido. Con estos halogenuros se pueden preparar distintos complejos. Se conoce el hidruro SbH3 (estibina), pero es poco estable y se descompone con mucha facilidad.Se conoce el trióxido de antimonio, Sb2O3 y el pentóxido, Sb2O5.
PRECAUCIONES
El antimonio y muchos de sus compuestos son tóxicos, debiéndose tener los mayores cuidados posibles en su manipulación. Reacciona violentamente con oxidantes fuertes (ejemplo: halógenos, permanganatos alcalinos y nitratos) originando riesgo de incendio y explosión. Reacciona en medio ácido con hidrógeno naciente produciendo un gas muy tóxico (estibamina). En contacto con ácidos concentrados en caliente, emite gases tóxicos (estibamina). Su temperatura de autoignición es 900 °C, y su almacenamiento debe realizarse separado de alimentos y piensos, oxidantes fuertes, ácidos, sustancias reductoras. Se debe manejar con guantes, gafas protectoras.

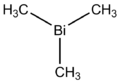
BISMUTO
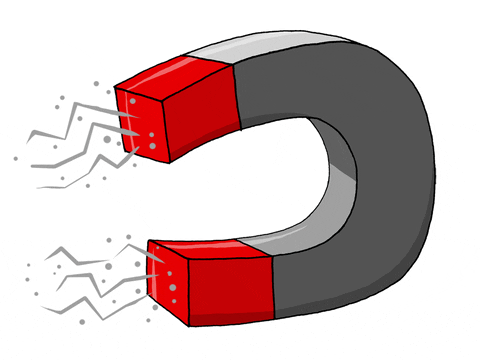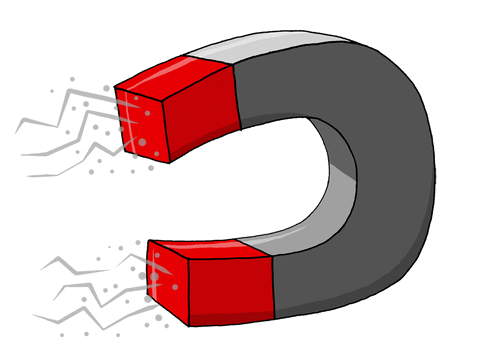
El bismuto es un elemento químico de la tabla periódica cuyo símbolo es Bi, su número atómico es 83 y se encuentra en el grupo 15 del sistema periódico.Ya era conocido en la antigüedad, pero hasta mediados del siglo XVIII era confundido con el plomo, estaño y zinc. Ocupa el lugar 73 en abundancia entre los elementos de la corteza terrestre (representa el 8,5x10-7 % del peso de la corteza) y es tan escaso como la plata. Los principales depósitos están en Sudamérica, pero en Estados Unidos se obtiene principalmente como subproducto del refinado de los minerales de cobre y plomo.Es un metal típico desde el punto de vista químico. En compuestos, tiene valencias de +3 (bismuto (III)) o +5 (bismuto (V)), siendo más estables los compuestos de bismuto trivalente. Existen varios nitratos, especialmente el nitrato de bismuto, Bi(NO3)3, o trinitrato de bismuto, y su pentahidrato, Bi(NO3)3•5H 2O, que se descompone en nitrato de bismuto. Éste también se conoce como oxinitrato de bismuto, nitrato de bismutilo, blanco perla y blanco de España, y se emplea en medicina y en cosmética.El bismuto se expande al solidificarse; esta extraña propiedad lo convierte en un metal idóneo para fundiciones. Algunas de sus aleaciones tienen puntos de fusión inusualmente bajos. Es una de las sustancias más fuertemente diamagnéticas (dificultad para magnetizarse). Es un mal conductor del calor y la electricidad, y puede incrementarse su resistencia eléctrica en un campo magnético, propiedad que lo hace útil en instrumentos para medir la fuerza de estos campos. Entre los elementos no radiactivos, el bismuto tiene el número atómico y la masa atómica (208,98) más altos. Tiene un punto de fusión de 271 °C, un punto de ebullición de 1560 °C y una densidad de 9800 kg/m³.
Historia
El bismuto es uno de los primeros diez metales que fueron descubiertos, ya conocido desde la antigüedad, por lo que a ninguna persona se le atribuye su descubrimiento. A partir de Johann Heinrich Pott en 1738, Carl Wilhelm Scheele y Torbern Olof Bergman, la distinción entre el plomo y el bismuto se hizo evidente, y Claude François Geoffroy demostró en 1753 que este metal era distinto del plomo y del estaño.El bismuto también era conocido por los incas y fue utilizado (junto con el habitual cobre y estaño) en una aleación de bronce especial para cuchillos.
El bismuto es uno de los primeros diez metales que fueron descubiertos, ya conocido desde la antigüedad, por lo que a ninguna persona se le atribuye su descubrimiento.
CARACTERÍSTICAS DEL BISMUTO
Cuando es sólido flota sobre su estado líquido, por tener menor densidad en el estado sólido. Esta característica es compartida con el agua, el galio, el ácido acético, el antimonio y el silicio.En casi todos los compuestos de bismuto aparece en forma trivalente, no obstante, en ocasiones puede ser pentavalente o monovalente. El bismutato de sodio y el pentafluoruro de bismuto son quizá los compuestos más importantes de Bi(V). El primero es un agente oxidante poderoso y el último un agente fluorante útil para compuestos orgánicos.El átomo de bismuto se sigue considerando popularmente como el más pesado entre los átomos estables, ya que su tiempo de vida es varios millones la edad total del Universo. Es también el elemento no radiactivo monoatómico más pesado que existe.El bismuto es uno de los dos peores conductores térmicos que existen entre todos los metales; es también el metal más diamagnético y sus aleaciones aprovechan ambas ventajas en situaciones donde se requiera. No existe de manera natural en el cuerpo humano ni en ninguna forma de vida en general. Se utiliza mucho en medicina, siendo parte de los astringentes recetados para problemas relacionados con el sistema digestivo, diarreas fuertes o irritaciones esofágicas, del colon, duodeno o intestinos.Químicamente recuerda a los metales nobles y preciosos, se oxida con dificultad y se mantiene en algunos ácidos como el clorhídrico. Puede presentarse en estado nativo, hecho que refuerza su nobleza. El metal es gris con un muy ligero toque rosado, muy «vidrioso» y frágil, no soporta un impacto mínimo, su ductilidad y maleabilidad es nula. De no ser por su escasez, podría reemplazar al plomo como escudo antinuclear debido a la gran masa atómica que posee.El bismuto se considera un metal pesado pero es irónicamente muy poco tóxico, prácticamente no agresivo, pese a estar rodeado de metales venenosos y peligrosos para el medioambiente. Sus cristales pueden ser trabajados hasta conseguir resultados de una increíble belleza.
El bismuto será el último elemento en desintegrarse en el universo. La vida media del elemento se estima en 20 trillones de años.
APLICACIONES
Sustituto del plomo
La diferencia entre las densidades del plomo (densidad 11.32 g·cm−3) y del bismuto (densidad 9.78 g·cm−3) es lo suficientemente pequeña para que pueda ser utilizado en lugar del plomo en numerosos usos en balística y como balasto. Por ejemplo, puede reemplazar al plomo como material en plomadas para la pesca. Ha sido utilizado como substituto del plomo en munición de perdigones, balines y balas para dispersar multitudes. En estos casos ciertas aleaciones de bismuto-estaño ofrecen una alternativa con propiedades similares al plomo para uso en balística. Sin embargo, dado que el bismuto es muy poco maleable, no es un material adecuado para fabricar balas de caza del tipo expansivas.Al ser el bismuto un elemento denso con un peso atómico elevado, es utilizado para fabricar escudos de látex impregnados con bismuto para protección de los rayos-X durante exámenes médicos, tales como tomografías computarizadas con rayos X, principalmente porque se le considera un elemento no tóxico.
Cosméticos y pigmentos
El oxicloruro de bismuto (BiOCl) a veces es utilizado en cosméticos, como pigmento en pintura para sombra de ojos, espray para el cabello y esmalte para uñas. El compuesto se presenta en la naturaleza como el mineral bismoclita y la forma cristalina contiene capas de átomos que refractan la luz en forma cromática, produciendo un aspecto iridiscente similar al nácar de las perlas. Fue utilizado como cosmético en el antiguo Egipto y en muchas otras civilizaciones desde entonces. El término blanco de bismuto puede hacer referencia al oxicloruro de bismuto o al oxinitrato de bismuto (BiONO3), cuando son utilizados como pigmentos blancos.
Toxicidad
El salicilato de bismuto y el tioglicolato de bismuto utilizados para combatir la lúes y otros tipos de enfermedades infecciosas o parasitarias pueden causar, cuando se administran por vía parenteral, un cuadro de intoxicación por bismuto. El nitrato de bismuto administrado por vía oral puede metabolizarse en nitritos que se absorben en el intestino y son metahemoglobinizantes.La intoxicación aguda causa cefaleas, gastroenteritis, hepatopatías, anuria y shock. En la intoxicación crónica hay estomatitis, ribete gingival azulado, enteritis, ictericia, nefropatías y dermatitis de tipo exantemático o exfoliativo.
Estados de oxidación
Estados de oxidación
Bismuto (III)El catión Bi3+, debido a su moderadamente alta acidez, se encuentra solamente en soluciones altamente ácidas en estado de equilibrio con sus óxidos. El catión Bi3+es incoloro debido a la estabilidad de su configuración electrónica ([Xe] 6s2) que impide transiciones electrónicas en longitudes de onda del espectro visible.
Comportamiento ácido-base
Al aumentar la alcalinidad del medio, el catión nos Bi3+ forma principalmente las especies monohidroxobismuto(III), BiOH2+, y el catión bismutilo, BiO+.A pH altamente alcalino se produce el hidróxido de bismuto(III), Bi(OH)3, que por deshidratación genera el trióxido de dibismuto, Bi2O3, un sólido de color amarillo.En medios extremadamente alcalinos se forma el anión bismutito, BiO2-.
Presencia en compuestos orgánicos
Bismuto (V)
A diferencia del bismuto (III), no se encuentra libre como catión ni en medios muy ácidos por su alta inestabilidad debida al alto valor de su relación carga/masa.
Algunos de los compuestos en los que se encuentra son:- Bi2O5, pentóxido de dibismuto
- BiF5, fluoruro de bismuto(V)
- NaBiO3, metabismutato de sodio
MOSCOVIO
El moscovio es un elemento sintético de la tabla periódica cuyo símbolo es Mc y su número atómico es 115.Actualmente se conocen cuatro isótopos desde 287Mc hasta 290Mc. Se prevé que el isótopo más estable del moscovio sea el 299Mc, que contiene el número mágico de 184 neutrones. El isótopo con mayor número de neutrones conocido hasta la fecha es el 290Mc, con 175 neutrones. Es muy inestable, con una vida media de milésimas de segundo. Su nombre hace referencia a la provincia de Moscú, región a la que pertenece la ciudad rusa donde se descubrió, Dubná.

- Bi2O5, pentóxido de dibismuto
- BiF5, fluoruro de bismuto(V)
- NaBiO3, metabismutato de sodio

DESCUBRIMIENTOEl 2 de febrero de 2004 se informó en la revista Physical Review C que un equipo integrado por científicos rusos en el Instituto Central de Investigaciones Nucleares en Dubná,y los científicos estadounidenses en el Lawrence Livermore National Laboratory hicieron el descubrimiento del moscovio. El equipo informó que bombardearon americio 243 con calcio 48 para producir iones de cuatro átomos de moscovio. Estos átomos se desintegraron por emisión de partículas alfa en nihonio en aproximadamente 100 milisegundos.
La clave de la estabilidad radica en que el núcleo del átomo sea lo más esférico posible, algo que, según Seaborg, puede ocurrir si posee al menos 298 nucleones (la suma de los protones y los neutrones). En el caso del experimento realizado recientemente por investigadores suizos, dirigidos por el doctor Heinz Gäggeler, la vida del nuevo átomo fue muy breve: una décima de segundo. Pero eso sólo indica que con el proceso empleado (bombardear un disco de americio con un rayo de iones de calcio) se ha obtenido un isótopo del elemento 115 que no llega a alcanzar la tan esquiva estabilidad.Por otra parte y aunque parezca sorprendente, ésta no fue la primera vez que se tiene conocimiento de dicho elemento, ya que en noviembre de 1989, Bob Lazarapareció en una entrevista especial con el periodista e investigador George Knapp en la cadena de televisión de Las Vegas KLAS-TV para hablar de diversos asuntos, de los cuales, uno de ellos trataba acerca del descubrimiento y el uso en bases militares estadounidenses del elemento 115, también conocido como Moscovio.
El moscovio en la tabla periódica de los elementos
El 5 de diciembre del 2016 la Unión Internacional de Química Pura y Aplicada (IUPAC) y la Unión Internacional de Física Pura y Aplicada (IUPAP) aprobaron su denominación .Además fue agregado a la tabla periódica de los elementos.
GRUPO VIA DE LA TABLA PERIÓDICA
Elementos de la familia del oxígeno.
El oxígeno (O) es el elemento más abundante en la corteza terrestre y el
segundo en la atmósfera; se combina fácilmente con la mayoría de los demás
elementos. El azufre (S) reacciona directamente con el oxígeno, formando una
llama azul; se emplea en la producción de pólvora. Su principal compuesto
es el ácido sulfúrico, utilizado en la fabricación de fertilizantes, detergentes y
pigmentos. El selenio (Se) se emplea en los procesos de fotocopiado. El polonio
(Po) es un elemento radioactivo que se emplea en los satélites.El grupo 16 está formado por los siguientes elementos: Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te), Polonio (Po) y el elemento sintético Livermorio (Lv).
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se muestra en cantidad en estado elemental y combinado formando compuestos. El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores. En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se muestra en cantidad en estado elemental y combinado formando compuestos. El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores. En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
PROPIEDADES FÍSICAS DEL GRUPO
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta del selenio al polonio.
El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.
El selenio es un metaloide que presenta, al igual que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal, el cual está compuesto por moléculas Se8. El selenio negro vítreoformado por anillos Son con muy grande y variable (forma amorfa) y por último el selenio gris cristalino de estructura hexagonal, la cual es la forma más común y análoga a la del azufre plástico. Este alótropo exhibe aspecto metálico, de hecho es un semimetal y es fotoconductor.
El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
Y finalmente el polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.
El selenio es un metaloide que presenta, al igual que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal, el cual está compuesto por moléculas Se8. El selenio negro vítreoformado por anillos Son con muy grande y variable (forma amorfa) y por último el selenio gris cristalino de estructura hexagonal, la cual es la forma más común y análoga a la del azufre plástico. Este alótropo exhibe aspecto metálico, de hecho es un semimetal y es fotoconductor.
El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
Y finalmente el polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
PROPIEDADES QUÍMICAS DEL GRUPO
Los elementos del grupo 16 ostentan algunas propiedades químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
OXIGENO
El oxígeno es un elemento químico de número atómico 8 y representado por el símbolo O. Su nombre proviene de las raíces griegas ὀξύς (oxys) («ácido», literalmente «punzante» y –γόνος (-gonos) («productor», literalmente «engendrador»; es decir, "productor de ácidos"), porque en la época en que se le dio esta denominación se creía, incorrectamente, que todos los ácidos requerían oxígeno para su composición. En condiciones normales de presión y temperatura, dos átomos del elemento se enlazan para formar el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Esta sustancia constituye una importante parte de la atmósfera y resulta necesaria para sostener la vida terrestre.Forma parte del grupo de los anfígenos en la tabla periódica y es un elemento no metálico altamente reactivo que forma fácilmente compuestos (especialmente óxidos) con la mayoría de elementos, excepto con los gases nobles helio y neón. Asimismo, es un fuerte agente oxidante y tiene la segunda electronegatividad más alta de todos los elementos, solo superada por el flúor. Medido por su masa, el oxígeno es el tercer elemento más abundante del universo, y el más abundante en la corteza terrestre ya que forma, prácticamente, la mitad de su masa. Debido a su reactividad química, no puede permanecer en la atmósfera terrestre como elemento libre sin ser reabastecido constantemente por la acción fotosintética de los organismos que utilizan la energía solar para producir oxígeno elemental a partir del agua. El oxígeno elemental O2 solamente empezó a acumularse en la atmósfera después de la aparición de estos organismos, aproximadamente hace 2500 millones de años. El oxígeno diatómico constituye el 20,8 % del volumen de la atmósfera terrestre.
Dado que constituye la mayor parte de la masa del agua, es también el componente mayoritario de la masa de los seres vivos. Muchas de las moléculas más importantes que forman parte de los seres vivos, como las proteínas, los ácidos nucleicos, los carbohidratos y los lípidos, contienen oxígeno, así como los principales compuestos inorgánicos que forman los caparazones, dientes y huesos animales. El oxígeno elemental se produce por cianobacterias, algas y plantas y todas las formas complejas de vida lo usan para su respiración celular. Resulta tóxico para los organismos de tipo anaerobio obligado, las formas tempranas de vida que predominaban en la Tierra hasta que el O2 comenzó a acumularse en la atmósfera. Otra forma (alótropa) del oxígeno, el ozono (O3), ayuda a proteger la biosfera de la radiación ultravioleta a gran altitud, en la llamada capa de ozono, pero es contaminante cerca de la superficie, donde es un subproducto del esmog.
Carl Wilhelm Scheele descubrió el oxígeno de forma independiente en Upsala en 1773, o incluso antes, y Joseph Priestley, en Wiltshire en 1774, pero el honor suele adjudicársele a Priestley debido a que publicó su trabajo antes. Antoine Lavoisier, acuñó el nombre «oxígeno» en 1777.El oxígeno se utiliza en la producción de acero, plásticos y textiles; los propulsores de cohetes; la oxigenoterapia; y la asistencia para la respiración en aeronaves, submarinos, vuelos espaciales y submarinos
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
CARACTERÍSTICASESTRUCTURAEn condiciones normales de presión y temperatura, el oxígeno es un gas incoloro e inodoro con fórmula molecular O2, en el que dos átomos de oxígeno se enlazan con una configuración electrónica en estado triplete. Este enlace tiene un orden de enlace de dos y se suele simplificar en las descripciones como un enlace doble o como una combinación de un enlace de dos electrones y dos enlaces de tres electrones.El oxígeno triplete —no debe confundirse con el ozono, O3— es el estado fundamental de la molécula O2, que cuenta con dos electrones desparejados que ocupan dos orbitales moleculares degenerados. Estos orbitales se clasifican como antienlaces debilitan el orden de enlace de tres a dos.En su forma normal de triplete, las moléculas de O2 son paramagnéticas; es decir, que en presencia de un campo magnético forman un imán, debido al momento magnético del espín de los electrones desparejados en la molécula y la interacción de canje negativa entre moléculas de O2 contiguas. Un imán atrae al oxígeno líquido hasta tal punto que, en demostraciones de laboratorio, un hilo de oxígeno líquido puede sostenerse contra su propio peso entre los polos de un imán potente.El oxígeno molecular singlete es un nombre dado a varias especies de O2 de mayor energía, en las que todos los espínes de los electrones se emparejan. Es mucho más reactivo con moléculas orgánicas habituales que el oxígeno molecular en sí mismo. En la naturaleza, el oxígeno singlete se suele formar con el agua en la fotosíntesis, usando la energía solar.
Alótropos
El alótropo más normal del oxígeno elemental es el llamado dioxígeno (O2), que tiene una longitud de enlace de 121 pm y una energía de enlace de 498 kJ•mol−1. Esta es la forma que usan las formas de vida complejas, como los animales, en su respiración celular y es la forma que tiene una gran importancia en la composición de la atmósfera terrestre..El trioxígeno (O3) se conoce habitualmente como ozono y es un alótropo muy reactivo, dañino para el tejido pulmonar.El ozono se produce en la atmósfera superior cuando el O2 se combina con el oxígeno atómico a causa de la división del O2 por la radiación ultravioleta. Ya que el ozono es un poderoso absorbente en la región ultravioleta del espectro electromagnético, la capa de ozono de la atmósfera superior funciona como un escudo protector de la radiación que recibe el planeta. Cerca de la superficie terrestre, no obstante, es un contaminante formado como subproducto de las emisiones de automóviles. La molécula metaestable del tetraoxígeno (O4) no fue descubierta hasta 2001, y se dio por descontado que existía en una de las seis fases del oxígeno sólido. Este clúster tiene potencial para ser un oxidante mucho más potente que el O2 y el O3 y podría, por tanto, ser usado como propulsor de cohetes. En 1990 se descubrió una fase metálica cuando el oxígeno sólido se somete a una presión superior a 96 GPay se demostró en 1998 que a temperaturas muy bajas se convierte en superconductor.
Propiedades físicas
El oxígeno es más soluble en agua que el nitrógeno; esta contiene aproximadamente una molécula de O2 por cada dos moléculas de N2, comparado con la proporción en la atmósfera, que viene a ser de 1:4. La solubilidad del oxígeno en el agua depende de la temperatura, disolviéndose alrededor del doble (14,6 mg•L−1) a 0 °C que a 20 °C (7,6 mg•L−1). A 25 °C y 1 atmósfera de presión, el agua dulce contiene alrededor de 6,04 mililitros (ml) de oxígeno por litro, mientras que el agua marina contiene alrededor de 4,95 ml por litro. A 5 °C la solubilidad se incrementa hasta 9,0 ml (un 50 % más que a 25 °C) por litro en el agua y 7,2 ml (45 % más) en el agua de mar.
El oxígeno se condensa a 90,20 K (−182,95 °C, −297,31 °F) y se congela a 54,36 K (−218,79 °C, −361,82 °F). Tanto el O2líquido como el sólido son sustancias con un suave color azul cielo causado por la absorción en el rojo, en contraste con el color azul del cielo, que se debe a la dispersión de Rayleigh de la luz azul. El O2 líquido de gran pureza se suele obtener a través de la destilación fraccionada de aire licuado. El oxígeno líquido también puede producirse por condensación del aire, usando nitrógeno líquido como refrigerante. Es una sustancia altamente reactiva y debe separarse de materiales inflamables.
Isótopos y origen estelar
El oxígeno que encontramos en la naturaleza se compone de tres isótopos estables: 16O, 17O y 18O, de los que el 16O es el más abundante (99,762 % de abundancia natural).La mayor parte del 16O se sintetiza al final del proceso de combustión del helio en una estrella masiva, pero otra parte se produce en el proceso de combustión del neón. El 17O surge fundamentalmente por la combustión del hidrógeno en helio durante el ciclo CNO, convirtiéndolo en un isótopo común en las zonas de combustión de hidrógeno en las estrellas. 18O se produce cuando el 14N —que abunda debido a la combustión CNO— captura un núcleo de 4He, lo que origina una gran abundancia de 18O en las zonas ricas en helio de las estrellas masivas.Se han caracterizado catorce radioisótopos, de los que los más estables son el O con un periodo de semidesintegración de 70,606 segundos. Todos los restantes isótopos radiactivos tienen periodos de semidesintegración inferiores a 27 segundos y la mayor parte de estos, inferiores a 83 milisegundos.
Abundancia
El oxígeno es el elemento químico más abundante, por masa, en la biosfera, el aire, el mar y el suelo terrestres. Es, asimismo, el tercero más abundante en el universo, tras el hidrógeno y el helio. Alrededor del 0,9 % de la masa del Sol es oxígeno, que constituye también el 49,2 % de la masa de la corteza terrestre y es el principal componente de los océanos de la Tierra (88,8 % de su masa total). El oxígeno gaseoso es el segundo componente más abundante en la atmósfera terrestre, ya que supone un 20,8 % de su volumen y el 23,1 % de su masa . La Tierra es una excepción entre los planetas del Sistema Solar por la alta concentración de oxígeno gaseoso en su atmósfera.La inusualmente alta concentración de oxígeno gaseoso en la Tierra es el resultado del ciclo de circulación. Este ciclo biogeoquímico describe el movimiento del oxígeno en el interior de sus tres principales reservas en el planeta: la atmósfera, la biosfera y la litosfera. El factor de conducción más importante en este ciclo es la fotosíntesis, responsable de la atmósfera moderna de la Tierra, que libera oxígeno en la atmósfera, mientras que los procesos de respiración y descomposición lo eliminan. En el equilibrio actual, la producción y el consumo tienen lugar con un ratio aproximado de 1/2000 de la totalidad del oxígeno atmosférico por año.
Rol biológico
Fotosíntesis y respiración
El oxígeno es liberado por las bacterias fotosintéticas, las algas y las plantas mediante la fotosíntesis. En el proceso inverso los organismos aerobios, mediante la respiración, usan el oxígeno para convertir los nutrientes en energía (ATP). La disminución de oxígeno provoca hipoxemia y su falta total, anoxia, lo que puede provocar la muerte del organismo.En la naturaleza el oxígeno no combinado se produce por la fotodescomposición del agua durante la fotosíntesis. Según algunas estimaciones, las algas verdes y las cianobacterias de ambientes marinos proporcionan alrededor del 70 % del producido en la Tierra, y las plantas terrestres. Una fórmula global simplificada de la fotosíntesis es:
6 CO2 + 6 H2O + fotones → C6H12O6 + 6 O2 dióxido de carbono + agua + luz solar → glucosa + dioxígeno La evolución fotolítica del oxígeno tiene lugar en las membranas tilacoides de los organismos fotosintéticos y requiere la energía de cuatro fotones. Están implicados muchos procesos, pero el resultado es la formación de un gradiente de un protón a través de la membrana tilacoide, que se usa para sintetizar adenosín trifosfato (ATP) por la fotofosforilación. El O2restante tras la oxidación de la molécula de agua se libera a la atmósfera.El dioxígeno molecular es esencial para la respiración celular en todos los organismos aerobios, ya que las mitocondrias lo usan para ayudar a generar adenosín trifosfato durante la fosforilación oxidativa. La reacción para la respiración aerobia es básicamente lo contrario que la fotosíntesis y se simplifica de la siguiente forma:C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2880 kJ•mol−1
AZUFRE
El azufre es un elemento químico de número atómico 16 y símbolo S (del latín sulphur). Es un no metal abundante con un color amarillo característico. Dicho elemento es generado en estrellas masivas en las que predominan temperaturas que provocan la fusión entre un núcleo de silicio y otro de helio en un proceso denominado nucleosíntesis de supernovas.El azufre se encuentra en forma nativa en regiones volcánicas y en sus formas reducidas formando sulfuros y sulfosales o bien en sus formas oxidadas como sulfatos. Es un elemento químico esencial constituyente de los aminoácidoscisteina y metionina y, por consiguiente, necesario para la síntesis de proteínas presentes en todos los organismos vivos. Se usa principalmente como fertilizante pero también en la fabricación de pólvora, laxantes, fósforos e insecticidas.
Características principalesEste no metal tiene un color amarillento fuerte, amarronado o anaranjado y arde con llama de color azul, desprendiendo dióxido de azufre. Es insoluble en agua pero se disuelve en disulfuro de carbono y benceno. Es multivalente, y son comunes los estados de oxidación -2, +2, +4, +6.En todos los estados (sólido, líquido y gaseoso): según los químicos presenta formas alotrópicas cuyas relaciones no son completamente conocidas. Las estructuras cristalinas más comunes son el octaedro ortorrómbico (azufre α) y el prisma monoclínico (azufre β), siendo la temperatura de transición de una a otra de 96 °C; en ambos casos el azufre se encuentra formando moléculas de S8 con forma de anillo, y es la diferente disposición de estas moléculas la que provoca las distintas estructuras cristalinas. A temperatura ambiente, la transformación del azufre monoclínico en ortorrómbico, es más estable y muy lenta.Al fundir el azufre, se obtiene un líquido que fluye con facilidad formado por moléculas de S8. Sin embargo, si se calienta, el color se torna marrón algo rojizo, y se incrementa la viscosidad. Este comportamiento se debe a la ruptura de los anillos y la formación de largas cadenas de átomos de azufre, que pueden alcanzar varios miles de átomos de longitud, que se enredan entre sí disminuyendo la fluidez del líquido; el máximo de la viscosidad se alcanza en torno a los 200 °C. Enfriando rápidamente este líquido viscoso se obtiene una masa elástica, de consistencia similar a la de la goma, denominada «azufre plástico» (azufre γ) formada por cadenas que no han tenido tiempo de reordenarse para formar moléculas de S8; transcurrido cierto tiempo la masa pierde su elasticidad cristalizando en el sistema rómbico. Estudios realizados con rayos X muestran que esta forma deforme puede estar constituida por moléculas de S8 con estructura de hélice espiral.En estado vapor también forma moléculas de S8, pero a 780 °C ya se alcanza el equilibrio con moléculas diatómicas y por encima de aproximadamente 1800 °C la disociación es completa y se encuentran átomos de azufre.Además de en trozos, barras o polvo grueso, existe en el mercado una presentación en forma de polvo muy fino, llamada "Flor de azufre", que puede obtenerse por precipitación en medio líquido o por sublimación de su vapor sobre una placa metálica fría. Estas son sus reacciones: S+Zn=ZnS 2Al+3S=Al²S³ S+O²=SO² 6S+HNO³=H²SO⁴+6NO²+2H²OAplicaciones
El azufre se usa en multitud de procesos industriales, como la producción de ácido sulfúrico para baterías, la fabricación de pólvora y el vulcanizado del caucho.Los sulfitos se usan para blanquear el papel y en fósforos. El tiosulfato de sodio o amonio se emplea en la industria fotográfica como «fijador» ya que disuelve el bromuro de plata; y el sulfato de magnesio (sal de Epsom) tiene usos diversos como laxante, exfoliante, o suplemento nutritivo para plantas.También el azufre se emplea en la industria enológica como antiséptico. Uno de sus principales usos es como anhídrido sulfuroso.El azufre tiene usos como fungicida y en la manufactura de fosfatos fertilizantes.
HistoriaEl azufre es conocido desde la Antigüedad, y ya los egipcios lo utilizaban para purificar los templos.
En el Génesis (19,24), los hebreos decían que Dios (Yahvé) hizo llover sobre Sodoma y Gomorra azufre y fuego desde el cielo.Homero recomendaba, en el siglo IX a. C., evitar la pestilencia mediante la quema de azufre (zeio en griego, relacionado con Zeus).En Apocalipsis 20:10 se dice que el diablo será lanzado a un lago de fuego y azufre.Durante toda la Edad Media se vinculó a Satanás con los olores sulfurosos (relacionados con los volcanes, que se suponían eran entradas a los infierno subterráneos).
Abundancia y obtención
El azufre es un elemento muy abundante en la corteza terrestre, se encuentra en grandes cantidades combinado en forma de sulfuros (pirita, galena) y de sulfatos (yeso). En forma nativa se encuentra en las cercanías de aguas termales, zonas volcánicas y en minas de cinabrio, galena, esfalerita y estibina, y en Luisiana (Estados Unidos, primer productor mundial) se extrae mediante el proceso Frasch consistente en inyectar vapor de agua sobrecalentado para fundir el azufre que posteriormente es bombeado al exterior utilizando aire comprimido.También se obtiene separándolo del gas natural, si bien su obtención anteriormente era a partir de depósitos de azufre puro impregnado en cenizas volcánicas (Italia, y más recientemente Argentina).También está presente, en pequeñas cantidades, en combustibles fósiles (carbón y petróleo) cuya combustión produce dióxido de azufre que combinado con agua produce la lluvia ácida; . También se extrae del gas natural que contiene sulfuro de hidrógeno que una vez separado se quema para obtener azufre:- 2 H2S + O2 → 2 S + 2 H2O
El color distintivo de Ío, la luna volcánica de Júpiter, se debe a la presencia de diferentes formas de azufre en estado líquido, sólido y gaseoso. El azufre se encuentra, además, en varios tipos de meteoritos, y se cree que la mancha oscura que puede observarse cerca del cráter lunar Aristarco puede ser un depósito de azufre.
Estados de oxidación y CompuestosLa variedad de compuestos azufrados son consecuencia de una gran variedad de posibles estados de oxidación del átomo de azufre. Muchos de los olores desagradables de la materia orgánica se deben a compuestos de la materia que contienen azufre como el sulfuro de hidrógeno. Disuelto en agua es ácido (pKa1 = 7,00, pKa2 = 12,92) y reacciona con los metales. Los sulfuros metálicos se encuentran en la naturaleza, sobre todo el de hierro (pirita) que puede presentar resistencia negativa y la galena, sulfuro de plomo que es un semiconductor natural que fue usado como rectificador.
- 2 H2S + O2 → 2 S + 2 H2O
El nitruro de azufre polímero (SN)x, sintetizado en 1975 por Alan G. MacDiarmid y Alan J. Heeger, presenta propiedades metálicas, a pesar de estar constituido por no metales, e inusuales propiedades eléctricas y ópticas. Este trabajo sirvió de base para el posterior desarrollo, con Hideki Shirakawa, de plásticos conductores y semiconductores.Los óxidos más importantes son el dióxido de azufre, SO2 (formado por la combustión del azufre) que en agua forma una solución de ácido sulfuroso, y el trióxido de azufre, SO3, que en solución forma el ácido sulfúrico; siendo los sulfitos y sulfatos las sales respectivas.

SELENIO
El selenio es un elemento químico de la tabla periódica cuyo símbolo es Se, cuyo número atómico es 34. Pertenece a la familia de los no metales.
Características principalesEl selenio se puede encontrar en varias formas alotrópicas. El selenio amorfo existe en tres formas, la vítrea, negra, obtenida al enfriar rápidamente el selenio líquido, funde a 180 °C y tiene una densidad de 4,28 g/cm3; la roja, coloidal, se obtiene en reacciones de reducción; el selenio gris cristalino de estructura hexagonal, la forma más común, funde a 220,5 °C y tiene una densidad de 4,81 g/cm3; y la forma roja, de estructura monoclínica, funde a 221 °C y tiene una densidad de 4,39 g/cm3.

Es insoluble en agua y alcohol, ligeramente soluble en disulfuro de carbono y soluble en éter.Presenta el efecto fotoeléctrico, convirtiendo la luz en electricidad, y, además, su conductividad eléctrica aumenta al exponerlo a la luz. Por debajo de su punto de fusión es un material semiconductor tipo p, y se encuentra en su forma natural.
El selenio se usa con diversos fines. Su derivado, el selenio de amonio, por ejemplo, se ocupa en la fabricación de vidrio. Otro derivado, el sulfuro de selenio, se usa en lociones y champús como tratamiento para la dermatitis seborreica.
Papel biológico
El selenio es un micronutriente para todas las formas de vida conocidas que se encuentra en el pan, los cereales, el pescado, las carnes, las lentejas, la cáscara de las patatas y los huevos. Está presente en el aminoácido selenocisteína y también se puede encontrar como selenometionina, reemplazando al azufre de la cisteína y la metionina respectivamente. Forma parte de las enzimas glutatión peroxidasa y tiorredoxina reductasa.
Es antioxidante, ayuda a neutralizar los radicales libres, induce la apoptosis, estimula el sistema inmunológico e interviene en el funcionamiento de la glándula tiroides. Las investigaciones realizadas sugieren la existencia de una correlación entre el consumo de suplementos de selenio y la prevención del cáncer en humanos. De manera similar, algunos estudios han comprobado que algunas concentraciones de selenio resultan quimioprotectoras frente a la apoptosis inducida por estrés oxidativo. Aún es tema de investigación, pero se sabe que la forma química en la que se encuentra el selenio (selenito, selenato o selenoaminoácidos) afecta a su absorción y a su posible toxicidad. Los datos actuales apuntan a que la forma orgánica (formando parte de proteínas como selenoaminoácidos) es la más beneficiosa para los animales. Además potencia el buen humor.La deficiencia de selenio es relativamente rara, pero puede darse en pacientes con disfunciones intestinales severas o con nutrición exclusivamente parenteral, así como en poblaciones que dependan de alimentos cultivados en suelos pobres en selenio.
HistoriaEl selenio (del griego σελήνιον,"selénion", resplandor de la Luna y por selene o artemisa la diosa griega de la luna y los animales) fue descubierto en 1817 por Jöns Jacob Berzelius. Al visitar la fábrica de ácido sulfúrico de Gripsholm observó un líquido pardo rojizo que calentado al soplete desprendía un olor fétido que se consideraba entonces característico y exclusivo del telurio de hecho su nombre deriva de su relación con este elemento ya que telurio proviene del latín Tellus, la Tierra, resultando de sus investigaciones el descubrimiento del selenio. Más tarde, el perfeccionamiento de las técnicas de análisis permitió detectar su presencia en distintos minerales pero siempre en cantidades extraordinariamente pequeñas.
Abundancia y obtenciónEl selenio se encuentra muy distribuido en la corteza terrestre en la mayoría de las rocas y suelos se halla en concentraciones entre 0,1 y 2,0 ppm. Raramente se encuentra en estado nativo obteniéndose principalmente como subproducto de la refinación del cobre ya que aparece en los lodos de electrólisis junto al telurio (5-25 % Se, 2-10 % Te). La producción comercial se realiza por tostación con cenizas de sosa o ácido sulfúrico de los lodos.Primeramente se añade un aglomerante de cenizas de sosa y agua a los lodos para formar una pasta dura que se extruye o corta en pastillas para proceder a su secado. La pasta se tuesta a 530-650 °C y se sumerge en agua resultando selenio hexavalente que se disuelve como selenato de sodio (Na2SeO4). Este se reduce a seleniuro de sodio calentándolo de forma controlada obteniendo una solución de un vivo color rojo. Inyectando aire en la solución el seleniuro se oxida rápidamente obteniéndose el selenio. La reducción del selenio hexavalente también puede hacerse empleando ácido clorhídrico concentrado, o sales ferrosas e iones cloro como catalizadores.
El segundo método consiste en mezclar los lodos de cobre con ácido sulfúrico tostando la pasta resultante a 500-600 °C para obtener dióxido de selenio que rápidamente se volatiliza a la temperatura del proceso. Este se reduce a selenio elemental durante el proceso de lavado con dióxido de azufre y agua, pudiendo refinarse posteriormente hasta alcanzar purezas de 99,5-99,7 % de selenio.. El carbón suele contener entre 0,5 y 12 ppm de selenio, es decir, unas 80 o 90 veces el promedio que se encuentra en las minas de cobre, sin embargo su recuperación no se prevé que pueda realizarse en un futuro próximo.
IsótoposEl selenio tiene seis isótopos naturales, cinco de los cuales son estables: 74Se, 76Se, 77Se, 78Se, y 80Se. Los tres últimos también se presentan como productos de fusión, junto con 79Se que tiene una vida media de 295 000 años.
PrecaucionesEl selenio está considerado un elemento peligroso para el medio ambiente por lo que sus compuestos deben almacenarse en áreas secas evitando filtraciones que contaminen las aguas. Los residuos de selenio se tratan en solución ácida con sulfito de sodio, calentándolo después para obtener el selenio elemental que presenta una menor biodisponibilidad.

TELURIO
El telurio o teluro es un elemento químico cuyo símbolo es Te y su número atómico es 52. Es un metaloide que se encuentra en el grupo 16 y el periodo 5 de la Tabla periódica de los elementos.
Fue descubierto en 1782 en minerales de oro por Franz-Joseph Müller von Reichenstein, inspector jefe de minas en Transilvania (Rumanía). En principio se confundió el telurio con el antimonio. Fue Martin Heinrich Klaproth, en 1798, quien examinó el «metal problemático» de Müller y lo llamó telurio.El telurio es un elemento relativamente estable, insoluble en agua y ácido clorhídrico, pero soluble en ácido nítrico y en agua regia. Reacciona con un exceso de cloro para formar dicloruro de teluro, TeCl2 y tetracloruro de teluro, TeCl4. Se oxida con ácido nítrico y produce dióxido de teluro, TeO2, y con ácido crómico para dar ácido telúrico, H2TeO4. En combinación con el hidrógeno y ciertos metales, forma telururos, como el telururo de hidrógeno, H2Te, y el telururo de sodio, Na2Te. El teluro tiene un punto de fusión de 452° C, un punto de ebullición de 990° C, y una densidad relativa de 6,25. Su masa atómica es 127,60. Los compuestos de telurio se usan ampliamente en la química orgánica sintética para la reducción y oxidación, ciclofuncionalización, deshalogenación, reacciones de generación de carbaniones y eliminación de grupos protectores. Los compuestos organometálicos son intermedios en la síntesis de aminas, dioles y productos naturales. El telurio es un componente de importancia clave en los catalizadores de óxidos mixtos de alto rendimiento para la oxidación selectiva catalítica heterogénea de propano a ácido acrílico. En presencia de vapor de agua, la superficie del catalizador se enriquece en telurio y vanadio lo que se traduce en la mejora de la producción de ácido acrílico. El telurio puede usarse en sensores de amoníaco y cristales de telurita.
IsótoposSe conocen 29 isótopos del telurio, con masas atómicas que fluctúan entre 108 y 137. En la naturaleza hay 8 isótopos del telurio, de los cuales tres son radiactivos. El 128Te tiene el periodo de semidesintegración más largo conocido de todos los radioisótopos de telurio (2,2·1024 años). El telurio es el elemento con menor número atómico que puede experimentar la desintegración alfa. Con los isótopos del 106Te al 110Te, puede experimentar este tipo de desintegración.
Abundancia y obtención

El telurio puede obtenerse combinado con oro en la calaverita,un mineral metálico relativamente poco abundante. En abril de 2017 se publicó el hallazgo del mayor yacimiento de telurio del mundo, en aguas de las Islas Canarias (España), en los montes submarinos situados dentro de las aguas canarias llamadas "las abuelas de Canarias. Se calcula que el yacimiento tiene un total de unas 2670 toneladas de Telurio, unas 50 000 veces más que el hallazgo más grande encontrado hasta ahora.
Telururo de cadmio
El telururo de cadmio (CdTe) es un compuesto cristalino formado por cadmio y telurio. Se utiliza como ventana óptica de infrarrojos y como material de célula solar. Por lo general se intercala con sulfuro de cadmio para formar una célula fotovoltaica de unión pn. Normalmente, las células de CdTe utilizan una estructura n-i-p .

POLONIO
El polonio es un elemento químico en la tabla periódica de los elementos cuyo símbolo es Po y su número atómico es 84. Se trata de un raro metal altamente radiactivo, químicamente similar al telurio y al bismuto, presente en minerales de uranio.CaracterísticasEsta sustancia se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos. Está químicamente relacionado con el teluro y el bismuto. El polonio es un metal volátil, reducible al 50% tras 45 horas al aire a una temperatura de 54,8 °C (328 K). Ninguno de los 50 isotopos [numero estimado] de polonio es estable. Es extremadamente tóxico y altamente radiactivo. Se ha encontrado polonio en minerales de uranio, humo de tabaco y como contaminante. Todos los elementos a partir del polonio son significativamente radiactivos. Se encuentra en el grupo 16 y su número atómico es 84.
AplicacionesMezclado o aleado con berilio, el polonio puede ser una fuente de neutrones.Se utiliza también en dispositivos destinados a la eliminación de carga estática, en cepillos especiales para eliminar el polvo acumulado en películas fotográficas y también en fuentes de calor para satélites artificiales o sondas espaciales.

Este isótopo de polonio es un emisor alfa con un período de semidesintegración de 138,39 días. Un miligramo de 210Po emite tantas partículas alfa como 5 gramos de radio. Por ello libera gran cantidad de energía, alcanzando los dispositivos productores de calor (en los Generadores Termoeléctricos de Radioisótopos o RTG en inglés) una temperatura superior a los 750 K con tan sólo medio gramo. Un único gramo de este isótopo genera 130 vatios de potencia calórica.El 210Po se ha utilizado como fuente ligera de calor para dar energía a las células termoeléctricas de algunos satélites artificiales y sondas lunares.
Polonio-210 en el tabaco
La presencia de polonio en el humo de tabaco se conoce desde principios de los años 60. Algunas de las empresas tabacaleras más importantes del mundo han investigado, sin éxito, formas de eliminar esta sustancia durante 40 años. Sin embargo, nunca publicaron los resultados.
El polonio-210 contenido en los fertilizantes fosfatados es absorbido por las raíces de plantas (como el tabaco) y almacenado en sus tejidos. Las plantas fertilizadas con fosfatos de roca contienen polonio-210, y la radiación alfa que emite se estima que causa alrededor de 11 700 muertes anuales en todo el mundo por cáncer de pulmón.
Efectos negativos
La ingesta o inhalación de una cantidad excesiva puede tener las mismas consecuencias que tuvo la radiación de Hiroshima, pero individualmente. Estos efectos se pueden notar a partir del tercer día, no son inmediatos. Los primeros síntomas son la caída del pelo y las molestias gastrointestinales. A continuación, el hígado y los riñones fallan; se paraliza el metabolismo y la médula ósea. La muerte será por fallo multiorgánico. Si la exposición es reducida sólo pueden aparecer síntomas gastrointestinales. Estos son los siguientes síntomas:- Los efectos por exposición son fallos orgánicos, caída del cabello, dolores gástricos, daños de pulmón y riñones y fallo total del sistema inmune.
- si la intoxicación es baja los síntomas se atenúan hasta desaparecer en unos días.
- el tratamiento medico pasa por un quelante o compuesto químico que ayuda a expulsar el polonio 210 a través de las heces y la orina.
Historia
- Los efectos por exposición son fallos orgánicos, caída del cabello, dolores gástricos, daños de pulmón y riñones y fallo total del sistema inmune.
- si la intoxicación es baja los síntomas se atenúan hasta desaparecer en unos días.
- el tratamiento medico pasa por un quelante o compuesto químico que ayuda a expulsar el polonio 210 a través de las heces y la orina.
Historia
El polonio fue descubierto por Marie Curie-Skłodowska y Pierre Curie en 1898, y fue posteriormente renombrado en honor a la tierra natal de Marie Curie, Polonia. En aquella época, Polonia no era un país independiente y se encontraba bajo el dominio de Rusia, Prusia y Austria, y Marie albergaba la esperanza de que este nombramiento le añadiría notoriedad. Fue el primer elemento cuyo nombre derivaba de una controversia política.Fue el 1º elemento descubierto por el matrimonio Curie mientras investigaban las causas de la radiactividad de la pechblenda. La pechblenda, tras eliminar el uranio y el radio, era incluso más radiactiva que estos elementos juntos. Esto les llevó a encontrar el nuevo elemento. El electroscopio lo mostró separándolo con bismuto.
ObtenciónAunque es un elemento de procedencia natural, sólo está presente en los minerales de uranio natural en razón de 100 microgramos por tonelada.En 1934 se demostró que, cuando el bismuto natural (209Bi) es bombardeado con neutrones, se crea 210Bi, que se transforma mediante una desintegración beta en Polonio-210. Se puede crear polonio en cantidades de miligramos mediante este procedimiento, utilizando flujos de neutrones grandes, como los que se encuentran en los reactores nucleares.
PrecaucionesEl polonio es un elemento altamente tóxico (DL50 = 10ng (inhalados) o 50 ng (ingeridos) en seres humanos), radiactivo y de peligroso manejo. Incluso en cantidades de microgramos, el manejo de 210Po, es muy peligroso y requiere de equipamiento especial utilizado bajo estrictos procedimientos de seguridad.

LIVERMORIO
El livermorio (anteriormente llamado ununhexio, Uuh) es el nombre del elemento sintético de la tabla periódica cuyo símbolo es Lv y su número atómico es 116.Su nombre viene dado en honor al Laboratorio Nacional Lawrence Livermore (Lawrence Livermore National Laboratory), en Livermore, California.
Historia

En 1999, investigadores del Laboratorio Nacional Lawrence Berkeley anunciaron la creación del elemento 116, en un artículo publicado en una revista de los EEUU llamada Physical Review Letters, explican que lo hicieron cuando se observó el decaimiento-α de un átomo de mayor número atómico. El año siguiente publicaron su retracción tras ver que no eran capaces de volver a hacer el experimento. En junio de 2002, el director del laboratorio anunció que los datos del experimento habían sido falseados por su autor principal Victor Ninov.En junio de 2000, el Instituto Conjunto para la Investigación Nuclear, en la ciudad de Dubna, realizó estudios por los cuales se describió el decaimiento-α del isótopo 292Uuh que se produjo en la reacción de fusión de un núcleo de 248 Cm al ser bombardeado con iones de 48 Ca acelerados por un ciclotrón, como producto secundario se obtuvieron 4 neutrones. Tiene una vida media de cerca de 6 milisegundos (0,006 segundos). Luego de esto tiene un decaimiento-α en 288Fl (Flerovio) seguido de dos más consecutivos en otros átomos de menor número atómico para más tarde tener una fisión espontánea.Nuevos experimentos se hicieron entre finales de 2000 e inicios de 2001, pero estos fallaron en crear un nuevo átomo.El 2 de mayo de 2001, el mismo instituto informó sobre la síntesis de un segundo átomo en su cuarta ronda de estudios, y que las propiedades confirmaron una región de la estabilidad "aumentada", aunque son acreditados de gran calidad y cuidadosos la confirmación de estos resultados está todavía pendiente por falta de estudios entre ellos un estudio con rayos X que pruebe la conexión entre las reacciones y descendientes.
En octubre de 2006 se anunció que, en tres ocasiones, bombardeando átomos de californio-249 con iones de calcio-48 producían ununoctio (elemento 118), que posteriormente decaía a ununhexio en tiempos de milisegundos. Confirmando esto, la síntesis del elemento 116 habrá sido demostrada definitivamente.La reacción que crea el livermorio es:
Decae en 47 milisegundos a un isótopo previamente identificado del elemento 114, Fl.
- Aplicaciones
- Aplicaciones
Por su inestabilidad, vida media tan reducida y dificultad de obtención, en la actualidad son nulas las aplicaciones industriales, comerciales o propagandísticas de este elemento muy pesado por lo que su aplicación se relega sólo a la investigación científica.

GRUPO VIIA DE LA TABLA PERIÓDICA
Los halógenos reaccionan fácilmente con los metales formando sales. El cloro, el flúor y
el yodo son elementos esenciales a nivel biológico; por ejemplo, el yodo (I) contribuye
con el buen funcionamiento de la tiroides; el cloro (Cl) forma parte de los ácidos gástricos
y el flúor (F) interviene en la formación del esmalte dental. El bromo (Br) se emplea en el
recubrimiento de películas fotográficas.
El grupo 17 de la tabla periódica es también conocido como halógenos. El término halógeno procede del griego y significa formador de sales. Dicho término, surge por la propiedad que posee cada uno de los halógenos de formar, con el sodio, una sal similar a la sal común (cloruro de sodio).
El grupo 17 está formado por los siguientes elementos: flúor (F), cloro (Cl), bromo (Br), yodo (I), ástato (At) y tennessine (Ts).
Estos elementos se hallan en estado elemental formando moléculas diatómicas, aunque aún no está comprobado con el ástato), las cuales son químicamente activas y de fórmula X2. Posee la siguiente distribución electrónica: s2p5. Para llenar por completo su último nivel energético se necesita de un electrón más, por lo que poseen disposición a formar un ion mononegativo llamado haluro (X–).
Propiedades físicas.
- Son elementos no metálicos.
- El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
- Los halógenos se presentan en moléculas diatómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.
- Los puntos de fusión y ebullición aumentan al descender en el grupo.
- Estos elementos, a temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.
- El flúor es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
- El cloro es un gas amarillo verdoso de olor irritante y fuerte.
- El bromo es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.
- El yodo es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
- El ástato es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.
Propiedades químicas
- Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
- De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica. Ubicación de los halógenos en la tabla periódica
- Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
- Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
- Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).El flúor reacciona con hidrógeno en un globo.
- Reaccionan con algunos metales formando haluros metálicos, casi todos ellos iónicos. Reacción química entre el yodo y el aluminio para generar yoduro de aluminio.
FLUOR
El flúor es el elemento químico de número atómico 9 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos. Su símbolo es F.Es un gas a temperatura ambiente, de color amarillo pálido, formado por moléculas diatómicas F2. Es el más electronegativo y reactivo de todos los elementos. En forma pura es altamente peligroso, causando graves quemaduras químicas al contacto con la piel.
Características principalesEl flúor es el elemento más electronegativo y reactivo y forma compuestos con prácticamente todo el resto de elementos, incluyendo los gases nobles xenón y radón. Su símbolo es F. Incluso en ausencia de luz y a bajas temperaturas, el flúor reacciona explosivamente con el hidrógeno. El flúor diatómico, F2, en condiciones normales es un gas corrosivo de color amarillo casi blanco, fuertemente oxidante. Bajo un chorro de flúor en estado gaseoso, el vidrio, metales, agua y otras sustancias, se queman en una llama brillante. Siempre se encuentra en la naturaleza combinado y tiene tal afinidad por otros elementos, especialmente silicio, que no se puede guardar en recipientes de vidrio.
En disolución acuosa, el flúor se presenta normalmente en forma de ion fluoruro, F-. Otras formas son fluorocomplejos como el [FeF4]-, o el H2F+.Los fluoruros son compuestos en los que el ion fluoruro se combina con algún resto cargado positivamente.
Aplicaciones

El grupo 17 está formado por los siguientes elementos: flúor (F), cloro (Cl), bromo (Br), yodo (I), ástato (At) y tennessine (Ts).
Estos elementos se hallan en estado elemental formando moléculas diatómicas, aunque aún no está comprobado con el ástato), las cuales son químicamente activas y de fórmula X2. Posee la siguiente distribución electrónica: s2p5. Para llenar por completo su último nivel energético se necesita de un electrón más, por lo que poseen disposición a formar un ion mononegativo llamado haluro (X–).
Propiedades físicas.
- Son elementos no metálicos.
- El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
- Los halógenos se presentan en moléculas diatómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.
- Los puntos de fusión y ebullición aumentan al descender en el grupo.
- Estos elementos, a temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.
- El flúor es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
- El cloro es un gas amarillo verdoso de olor irritante y fuerte.
- El bromo es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.
- El yodo es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
- El ástato es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.
Propiedades químicas
- Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
- De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica. Ubicación de los halógenos en la tabla periódica
- Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
- Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
- Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).El flúor reacciona con hidrógeno en un globo.
- Reaccionan con algunos metales formando haluros metálicos, casi todos ellos iónicos. Reacción química entre el yodo y el aluminio para generar yoduro de aluminio.
- El politetrafluoroetileno (PTFE), también denominado teflón, se obtiene a través de la polimerización de tetrafluoroetileno que a su vez es generado a partir de clorodifluorometano, que se obtiene finalmente a partir de la fluoración del correspondiente derivado halogenado con fluoruro de hidrógeno (HF).
- También a partir de HF se obtienen clorofluorocarburos (CFC), hidroclorofluorocarburos (HClFC) e hidrofluorocarburos (HFC).
- Se emplea flúor en la síntesis del hexafluoruro de uranio, UF6, es el gas más pesado conocido y se emplea en el enriquecimiento de uranio 235U.
- El fluoruro de hidrógeno se emplea en la obtención de criolita sintética, Na3AlF6, la cual se usa en el proceso de obtención de aluminio.
- Hay distintas sales de flúor con variadas aplicaciones. El fluoruro de sodio, NaF, se emplea como agente fluorante; el difluoruro de amonio, NH4HF2, se emplea en el tratamiento de superficies, anodizado del aluminio, o en la industria del vidrio; el trifluoruro de boro, BF3, se emplea como catalizador; etc.
- Algunos fluoruros se añaden a las pastas de dientes para la prevención de caries (principalmente el fluoruro de sodio).
- En algunos países se añade fluoruro a las aguas potables para prevenir la aparición de caries, de lo que se suele avisar a la población. Algunos países como Estados Unidos o Australia fluoran el agua potable, mientras que otros como Alemania lo prohíben.
- Se emplea flúor monoatómico en la fabricación de semiconductores.
- El hexafluoruro de azufre, SF6, es un gas dieléctrico con aplicaciones electrónicas. Este gas contribuye al efecto invernadero y está recogido en el Protocolo de Kioto.
Historia
- El politetrafluoroetileno (PTFE), también denominado teflón, se obtiene a través de la polimerización de tetrafluoroetileno que a su vez es generado a partir de clorodifluorometano, que se obtiene finalmente a partir de la fluoración del correspondiente derivado halogenado con fluoruro de hidrógeno (HF).
- También a partir de HF se obtienen clorofluorocarburos (CFC), hidroclorofluorocarburos (HClFC) e hidrofluorocarburos (HFC).
- Se emplea flúor en la síntesis del hexafluoruro de uranio, UF6, es el gas más pesado conocido y se emplea en el enriquecimiento de uranio 235U.
- El fluoruro de hidrógeno se emplea en la obtención de criolita sintética, Na3AlF6, la cual se usa en el proceso de obtención de aluminio.
- Hay distintas sales de flúor con variadas aplicaciones. El fluoruro de sodio, NaF, se emplea como agente fluorante; el difluoruro de amonio, NH4HF2, se emplea en el tratamiento de superficies, anodizado del aluminio, o en la industria del vidrio; el trifluoruro de boro, BF3, se emplea como catalizador; etc.
- Algunos fluoruros se añaden a las pastas de dientes para la prevención de caries (principalmente el fluoruro de sodio).
- En algunos países se añade fluoruro a las aguas potables para prevenir la aparición de caries, de lo que se suele avisar a la población. Algunos países como Estados Unidos o Australia fluoran el agua potable, mientras que otros como Alemania lo prohíben.
- Se emplea flúor monoatómico en la fabricación de semiconductores.
- El hexafluoruro de azufre, SF6, es un gas dieléctrico con aplicaciones electrónicas. Este gas contribuye al efecto invernadero y está recogido en el Protocolo de Kioto.
A causa de ser tan reactivo y peligroso, el flúor no fue aislado hasta tiempos relativamente recientes, puesto que en estado puro es sumamente peligroso y es necesario manejarlo con extremo cuidado.El primer compuesto de flúor (del latín fluere, que significa "fluir") que se conoce data de los años 1500, en Alemania. Se trata de la fluorita (CaF2), por entonces llamada flúores, después espato de flúor. Es un mineral raro, que se funde fácilmente y era utilizado como fundente, para fundir otros minerales con mayor facilidad al mezclarlo con flúores. El mineralogista Georgius Agricola describió el mineral en 1529.En 1670, Enrique Schwandhard descubrió que al someter al mineral a algunos ácidos, desprendía un vapor muy corrosivo, que incluso corroía el vidrio. Utilizó esta propiedad para elaborar dibujos sobre el vidrio, por lo que mantuvo en secreto la forma de obtenerloSolo muy lentamente se avanzó en el estudio de este mineral. En 1768, Andrés Segismundo Sargraf estudió el mineral y obtuvo nuevamente el extraño vapor, informando sobre la característica que ataca al vidrio.Sin embargo, el primero en estudiar el gas fue Carlos Sabéele en 1780. A él se le atribuye el descubrimiento del ácido fluorhídrico. Murió a los 44 años, muy probablemente a causa de una intoxicación sistemática con los productos que manejaba.En 1813, Ampère hizo la hipótesis de que el ácido fluorhídrico era un compuesto de hidrógeno con un elemento todavía no descubierto. Esta hipótesis la hizo por la analogía que tiene este ácido con el muriático, del que se descubrió el cloro apenas tres años antes. Comunicó su hipótesis a Humphry Davy. Ampère sugirió el nombre de "pthor" al nuevo elemento, pero Davy se inclinó por el nombre "flúor".Desde entonces se sucedió una serie de intentos de aislar el flúor, todos fallidos, y la mayoría con accidentes de intoxicación. Comenzó el mismo Davy por medio de electrólisis, descomponiendo el fluoruro cálcico, pero no lo logró debido a que una vez aislado el flúor en el electrodo positivo, se combinaba rápidamente con cualquier elemento que estuviese cerca. En el proceso se intoxicó y probablemente a causa de eso tuvo una muerte temprana.En 1830 los hermanos Tomás y Jorge Knox intentaron aislar el flúor por medios químicos usando cloro. No lo lograron y también se intoxicaron seriamente.5P. Louyel también lo intentó en la misma época, fracasando también, pero en esta ocasión la intoxicación le causó la muerte.5Edmond Frémy (inicialmente ayudante de Louyel) abordó el tema con mucha mayor cautela y seguridad, lo que le valió librarse de la intoxicación. Regresó a la electrólisis y en el proceso fue el primero en obtener ácido fluorhídrico puro (anteriormente solo se lo obtenía mezclado con agua), pero tampoco logró el objetivo.
La primera producción comercial de flúor fue para la bomba atómica del Proyecto Manhattan, en la obtención de hexafluoruro de uranio, UF6, empleado para la separación de isótopos de uranio. Este proceso se sigue empleando para aplicaciones de energía nuclear.
Abundancia y obtención
El flúor es el halógeno más abundante en la corteza terrestre, con una concentración de 950 ppm. En el agua de mar esta se encuentra en una proporción de aproximadamente 1,3 ppm. Los minerales más importantes en los que está presente son la fluorita, CaF2, el fluorapatito, Ca5(PO4)3F y la criolita, Na3AlF6.- El flúor se obtiene mediante electrólisis de una mezcla de HF y KF. Se produce la oxidación de los fluoruros:
2F- → F2 + 2e-
- En el cátodo se descarga hidrógeno, por lo que es necesario evitar que entren en contacto estos dos gases para que no haya riesgo de explosión
Compuestos
- El flúor se obtiene mediante electrólisis de una mezcla de HF y KF. Se produce la oxidación de los fluoruros:
- 2F- → F2 + 2e-
- En el cátodo se descarga hidrógeno, por lo que es necesario evitar que entren en contacto estos dos gases para que no haya riesgo de explosión
 El oxígeno combustiona mejor con los HC porque siempre se forma CO2, en cambio con flúor pueden formarse perfluorcadenas que son bastante inertes. El compuesto más oxidante puede ser el O2)F2) o bien el ion XeF+. El flúor se puede obtener químicamente en reacciones de ácidos de Lewis.Se emplean numerosos compuestos orgánicos en los que se han sustituido formalmente átomos de hidrógeno por átomos de flúor. Hay distintas formas de obtenerlos, por ejemplo mediante reacciones de sustitución de otros halógenos: CHCl3 + 2HF → CHClF2 + 2HCl.
El oxígeno combustiona mejor con los HC porque siempre se forma CO2, en cambio con flúor pueden formarse perfluorcadenas que son bastante inertes. El compuesto más oxidante puede ser el O2)F2) o bien el ion XeF+. El flúor se puede obtener químicamente en reacciones de ácidos de Lewis.Se emplean numerosos compuestos orgánicos en los que se han sustituido formalmente átomos de hidrógeno por átomos de flúor. Hay distintas formas de obtenerlos, por ejemplo mediante reacciones de sustitución de otros halógenos: CHCl3 + 2HF → CHClF2 + 2HCl.- Los CFC se han empleado en una amplia variedad de aplicaciones, por ejemplo como refrigerantes, propelentes, agentes espumantes, aislantes, etc., pero debido a que contribuyen a la destrucción de la capa de ozono se han ido sustituyendo por otros compuestos químicos, como los HCF. Los HCFC también se emplean como sustitutos, pero también destruyen la capa de ozono, aunque en menor medida a largo plazo.
- El politetrafluoroetileno (PTFE), es un polímero denominado comúnmente teflón.
El fluoruro de hidrógeno es extremadamente corrosivo y reacciona violentamente con los alcalinos y el amoníaco anhidro. Destruye el tejido hasta el hueso, es más peligroso que el ácido sulfúrico y el ácido nítrico.- El ácido fluorhídrico es una disolución de fluoruro de hidrógeno en agua. Es un ácido débil, pero mucho más peligroso que ácidos fuertes como el clorhídrico o el sulfúrico atraviesa la piel destruye los tejidos y huesos, y es tóxico en cualquier concentración, además provoca hipocalcemia. El HF anhidro es extraordinariamente corrosivo.
Las disoluciones de HF son mortales aunque sean diluidas.- El hexafluoruro de uranio, UF6, es un gas a temperatura ambiente que se emplea para la separación de isótopos de uranio.
- El flúor forma compuestos con otros halógenos presentando el estado de oxidación -1, por ejemplo, IF7, BrF5, ClF, etcétera.
Dichos compuestos son muy reactivos: el ClF3 es aún más reactivo que el flúor, así como el BrF5,- La criolita natural, Na3AlF6, es un mineral que contiene fluoruros. Se extraía en Groenlandia, pero ahora está prácticamente agotada, por lo que se obtiene sintéticamente para ser empleada en la obtención de aluminio.
El HF anhidro y el ácido nítrico mezclados disuelven a la mayoría de los metales de transición, incluido el tántalo.
Efectos biológicos

- Los CFC se han empleado en una amplia variedad de aplicaciones, por ejemplo como refrigerantes, propelentes, agentes espumantes, aislantes, etc., pero debido a que contribuyen a la destrucción de la capa de ozono se han ido sustituyendo por otros compuestos químicos, como los HCF. Los HCFC también se emplean como sustitutos, pero también destruyen la capa de ozono, aunque en menor medida a largo plazo.
- El politetrafluoroetileno (PTFE), es un polímero denominado comúnmente teflón.
- El ácido fluorhídrico es una disolución de fluoruro de hidrógeno en agua. Es un ácido débil, pero mucho más peligroso que ácidos fuertes como el clorhídrico o el sulfúrico atraviesa la piel destruye los tejidos y huesos, y es tóxico en cualquier concentración, además provoca hipocalcemia. El HF anhidro es extraordinariamente corrosivo.
- El hexafluoruro de uranio, UF6, es un gas a temperatura ambiente que se emplea para la separación de isótopos de uranio.
- El flúor forma compuestos con otros halógenos presentando el estado de oxidación -1, por ejemplo, IF7, BrF5, ClF, etcétera.
- La criolita natural, Na3AlF6, es un mineral que contiene fluoruros. Se extraía en Groenlandia, pero ahora está prácticamente agotada, por lo que se obtiene sintéticamente para ser empleada en la obtención de aluminio.
Aunque el flúor es demasiado reactivo para tener alguna función biológica natural, se incorpora a compuestos con actividad biológica. Compuestos naturales organofluorados son raros, el ejemplo más notable es el fluoroacetato, que funciona como una defensa contra los herbívoros de plantas en al menos 40 plantas en Australia, Brasil y África.8 La enzima adenosil-fluoruro sintasa cataliza la formación de 5'- desoxi-5'-fluoroadenosina. El flúor no es un nutriente esencial, pero su uso tópico en la prevención de la caries dental es bien reconocida. El efecto es tópico (aplicación sobre la superficie del esmalte), aunque antes de 1981 se consideró principalmente sistémico (por ingestión).9 Su uso sistémico está actualmente desaconsejado por muchos autores.
Isótopos
El flúor tiene un único isótopo natural, el 19F. Este isótopo tiene un número cuántico de espín nuclear de 1/2 y se puede emplear en espectroscopia de resonancia magnética nuclear. Se suele emplear como compuesto de referencia el triclorofluorometano, CFCl3 o el trifluoroacético TFA.El 18F es un isótopo artificial emisor de positrones (emisor β+), que puede obtenerse por medio de un ciclotrón a partir del 18O (bajo la forma química de H218O). El 18F, por su emisión radiactiva (positrones, que al aniquilarse con los electrones del medio producen dos rayos gamma de 511 keV), se utiliza en el diagnóstico por tomografía por emisión de positrones (PET, de sus siglas en inglés), la cual tiene aplicaciones en Oncología, Neurología y Cardiología. El 18F se incorpora a moléculas orgánicas (proceso denominado "marcación con 18F"). Las mismas son aplicadas al paciente por medio de inyectables y el patrón de su distribución en el organismo permite el diagnóstico de tumores, zonas de baja perfusión cardíaca o cerebral, entre otras.
PrecaucionesEl flúor y el HF deben ser manejados con gran cuidado y se debe evitar totalmente cualquier contacto con la piel o con los ojos. El HF anhidro hierve a 19 °C, sus vapores son muy irritantes y tóxicos, sus descubridores murieron por su acción. Nunca ha de mezclarse con metales alcalinos ni con amoniaco. En presencia de SbF5, se convierte en un superácido (el HF anhidro). La capacidad de protonación es tan grande que oxida a metales como el cobre y protona al metano etc. Tanto el flúor como los iones fluoruro son altamente tóxicos. El flúor presenta un característico olor acre y es detectable en unas concentraciones tan bajas como 0,02 ppm, por debajo de los límites de exposición recomendados en el trabajo.
Toxicidad
La toxicidad del flúor viene por su afinidad a unirse al zinc (básico para el aprendizaje, la memoria y la formación de anticuerpos), y al yodo (básico para la tiroides y el sistema hormonal del cuerpo y otras funciones, siendo además el yodo quelante de mercurio), esto es similar al mercurio que se amalgama con el yodo y el zinc. Además, el exceso de flúor puede producir malformaciones óseas, aparte de un "endurecimiento y fragilidad" de los huesos con una mayor facilidad a su rotura. En definitiva, el flúor puede dañar el sistema de aprendizaje, memoria, salud, sistema hormonal, huesos, y así de energía y productividad de las personas.En la característica de unión con el yodo, se usa el flúor para tratar hipertiroidismos (un hiperdesarrollo de la tiroides, entre otras cosas por exceso de yodo). Al eliminar el yodo del cuerpo, el flúor reduce la tiroides, reduciendo su tamaño y actividad, siendo esto muy dañino para personas con tiroides normales (que hace una parte vital del sistema hormonal del cuerpo), y especialmente para las personas con una tiroides débil o hipotiroidismo. Esto se ve agravado si la persona está expuesta a contaminación por mercurio (amalgama de los dientes 55 % mercurio, lámparas halógenas/fluorescentes-cuando se funden o parpadean, contaminación minera, pescado contaminado, aire contaminado con altos niveles de diésel y del mercurio expulsado por su combustión, etc.), pues el mercurio también se une al zinc y al yodo, inutilizando sus funciones, se refuerza en el daño con el flúor.Un síntoma de intoxicación por flúor fácilmente perceptible en la población infantil (pues sus dientes están en formación), es la presencia de manchas blancas en los dientes.A nivel histórico, como anécdotas, en los primeros experimentos de refinamiento de uranio para hacer la bomba atómica, se pensaba que toda la toxicidad del proceso venía del uso de flúor.

CLORO El cloro es un elemento químico de número atómico 17 situado en el grupo de los halógenos (grupo VIIA) de la tabla periódica de los elementos. Su símbolo es Cl. En condiciones normales y en estado puro forma dicloro: un gas tóxicoamarillo-verdoso formado por moléculas diatómicas (Cl2) unas 2,5 veces más pesado que el aire, de olor desagradable y tóxico. Es un elemento abundante en la naturaleza y se trata de un elemento químico esencial para muchas formas de vida.
Características principales
En la naturaleza no se encuentra en estado puro ya que reacciona con rapidez con muchos elementos y compuestos químicos, por esta razón se encuentra formando parte de cloruros (especialmente en forma de cloruro de sodio), cloritos y cloratos , en las minas de sal y disuelto en el agua de mar.
En la naturaleza no se encuentra en estado puro ya que reacciona con rapidez con muchos elementos y compuestos químicos, por esta razón se encuentra formando parte de cloruros (especialmente en forma de cloruro de sodio), cloritos y cloratos , en las minas de sal y disuelto en el agua de mar.
Historia
El cloro (del griego χλωρος, que significa "verde pálido") fue descubierto en su forma diatómica en 1774 por el sueco Carl Wilhelm Scheele, aunque creía que se trataba de un compuesto que contenía oxígeno. Lo obtuvo a partir de la siguiente reacción:2 NaCl + 2H2SO4 + MnO2 → Na2SO4 + MnSO4 + 2 H2O + Cl2
En 1810 el químico inglés Humphry Davy demuestra que se trata de un elemento físico y le da el nombre de cloro debido a su color. El gas cloro se empleó en la Primera Guerra Mundial, siendo el primer caso de uso de armas químicas como el fosgeno y el gas mostaza.
Abundancia
- 2 NaCl + 2H2SO4 + MnO2 → Na2SO4 + MnSO4 + 2 H2O + Cl2
El cloro se encuentra en la naturaleza combinado con otros elementos formando principalmente sales iónicas; como es el caso del cloruro sódico y cálcico; también con la mayoría de metales; desde el cloruro de hafnio hasta el cloruro de plata. Podría decirse que el cloro combina de forma natural bastante bien con la mayoría de elementos, excepto con los de su grupo, halógenos y gases nobles, aunque en las últimas décadas de manera sintética forma parte de los mismos en compuestos conocidos como son los fluorocloruros y cloruros de xenón.Finalmente cabe destacar que la gran mayoría de estos compuestos suelen encontrarse con impurezas formando parte de minerales como la carnalita, KMgCl3·6H2O.
Obtención
El cloro comercial se obtiene por electrólisis en el proceso de preparación de los álcalis y se expande en forma líquida, no es puro; y por lo tanto, ha de purificarse.Si se trata el dióxido de manganeso hidratado con ácido clorhídrico concentrado se produce un gas exento en gran parte de impurezas tales como el oxígeno gas (O2(g)) y óxidos de cloro.4HCl + MnO2xH2O = MnCl2 + (x+2)H2O + Cl2
Compuestos
- Algunos cloruros metálicos se emplean como catalizadores. Por ejemplo, FeCl2, FeCl3, AlCl3.
- Ácido clorhídrico, HCl. Se emplea en la industria alimentaria, metalúrgia, desincrustante, productos de limpieza, abrillantador de pisos, destapador de caños y tuberías.
- Ácido hipocloroso, HClO. Se emplea en la depuración de aguas y alguna de sus sales como agente blanqueante.
- Ácido cloroso, HClO2. La sal de sodio correspondiente, NaClO2, se emplea para producir dióxido de cloro, ClO2, el cual se usa como desinfectante.
- Ácido clórico (HClO3). El clorato de sodio, NaClO3, también se puede emplear para producir dióxido de cloro, empleado en el blanqueo de papel, así como para obtener clorato.
- Ácido perclórico (HClO4). Es un ácido oxidante y se emplea en la industria de explosivos. El perclorato de sodio, NaClO4, se emplea como oxidante y en la industria textil y papelera.
- Compuestos de cloro como los clorofluorocarburos (CFC) contribuyen a la destrucción de la capa de ozono.
- Algunos compuestos orgánicos de cloro se emplean como pesticidas. Por ejemplo, el hexaclorobenceno (HCB), el para-diclorodifeniltricloroetano (DDT), el toxafeno, etcétera.
- Muchos compuestos organoclorados presentan problemas ambientales debido a su toxicidad, por ejemplo el pentacloroetano, los pesticidas anteriores, los bifenilos policlorados (PCB), o las dioxinas.
Isótopos
- Algunos cloruros metálicos se emplean como catalizadores. Por ejemplo, FeCl2, FeCl3, AlCl3.
- Ácido clorhídrico, HCl. Se emplea en la industria alimentaria, metalúrgia, desincrustante, productos de limpieza, abrillantador de pisos, destapador de caños y tuberías.
- Ácido hipocloroso, HClO. Se emplea en la depuración de aguas y alguna de sus sales como agente blanqueante.
- Ácido cloroso, HClO2. La sal de sodio correspondiente, NaClO2, se emplea para producir dióxido de cloro, ClO2, el cual se usa como desinfectante.
- Ácido clórico (HClO3). El clorato de sodio, NaClO3, también se puede emplear para producir dióxido de cloro, empleado en el blanqueo de papel, así como para obtener clorato.
- Ácido perclórico (HClO4). Es un ácido oxidante y se emplea en la industria de explosivos. El perclorato de sodio, NaClO4, se emplea como oxidante y en la industria textil y papelera.
- Compuestos de cloro como los clorofluorocarburos (CFC) contribuyen a la destrucción de la capa de ozono.
- Algunos compuestos orgánicos de cloro se emplean como pesticidas. Por ejemplo, el hexaclorobenceno (HCB), el para-diclorodifeniltricloroetano (DDT), el toxafeno, etcétera.
- Muchos compuestos organoclorados presentan problemas ambientales debido a su toxicidad, por ejemplo el pentacloroetano, los pesticidas anteriores, los bifenilos policlorados (PCB), o las dioxinas.
Isótopos
- En la naturaleza se encuentran dos isótopos estables de cloro. Uno de masa 35 uma, y el otro de 37 uma, con unas proporciones relativas de 3:1 respectivamente, lo que da un peso atómico para el cloro de 35,5 uma.El cloro tiene 9 isótopos con masas desde 32 uma hasta 40 uma. Solo tres de éstos se encuentran en la naturaleza: el 35Cl, estable y con una abundancia del 75,77 %, el 37Cl, también estable y con una abundancia del 24,23 %, y el isótopo radiactivo 36Cl. La relación de 36Cl con el Cl estable en el ambiente es de aproximadamente 700 × 10−15:1.El 36Cl se produce en la atmósfera a partir del 36Ar por interacciones con protones de rayos cósmicos. En el subsuelo se genera 36Cl principalmente mediante procesos de captura de neutrones del 35Cl, o por captura de muones del 40Ca. El 36Cl decae a 36S y a 36Ar, con un periodo de semidesintegración combinado de 308000 años.El período de semidesintegración de este isótopo hidrofílico y no reactivo lo hace útil para la datación geológica en el rango de 60 000 a un millón de años. Además, se produjeron grandes cantidades de 36Cl por la irradiación de agua de mar durante las detonaciones atmosféricas de armas nucleares entre 1952 y 1958. El tiempo de residencia del 36Cl en la atmósfera es de aproximadamente una semana. Así pues, es un marcador para las aguas superficiales y subterráneas de los años 1950, y también es útil para la datación de aguas que tengan menos de 50 años. El 36Cl se ha empleado en otras áreas de las ciencias geológicas, incluyendo la datación de hielo y sedimentos.
Núclido Abundancia Masa Espín Periodo de semidesintegración Producto de desintegración 32Cl - 31,9857 1 298 ms ε 33Cl - 32,9775 3/2 2,51 s ε 34Cl - 33,9738 0 1,53 s ε 35Cl 75,77 34,9689 3/2 - - 36Cl - 35,9683 2 301000 a β- 37Cl 24,23 36,9659 3/2 - - 38Cl - 37,9680 2 37,2 m β- 39Cl - 38,9680 3/2 55,6 m β- 40Cl - 39,9704 2 1,38 m β- 41Cl - 40,9707 n.m. 34 s β- 42Cl - 41,9732 n.m. 6,8 s β- 43Cl - 42,9742 n.m. 3,3 s β-
Aplicaciones y usos
Producción de insumos industriales y para consumoLas principales aplicaciones de cloro son en la producción de un amplio rango de productos industriales y para consumo.
- En la naturaleza se encuentran dos isótopos estables de cloro. Uno de masa 35 uma, y el otro de 37 uma, con unas proporciones relativas de 3:1 respectivamente, lo que da un peso atómico para el cloro de 35,5 uma.El cloro tiene 9 isótopos con masas desde 32 uma hasta 40 uma. Solo tres de éstos se encuentran en la naturaleza: el 35Cl, estable y con una abundancia del 75,77 %, el 37Cl, también estable y con una abundancia del 24,23 %, y el isótopo radiactivo 36Cl. La relación de 36Cl con el Cl estable en el ambiente es de aproximadamente 700 × 10−15:1.El 36Cl se produce en la atmósfera a partir del 36Ar por interacciones con protones de rayos cósmicos. En el subsuelo se genera 36Cl principalmente mediante procesos de captura de neutrones del 35Cl, o por captura de muones del 40Ca. El 36Cl decae a 36S y a 36Ar, con un periodo de semidesintegración combinado de 308000 años.El período de semidesintegración de este isótopo hidrofílico y no reactivo lo hace útil para la datación geológica en el rango de 60 000 a un millón de años. Además, se produjeron grandes cantidades de 36Cl por la irradiación de agua de mar durante las detonaciones atmosféricas de armas nucleares entre 1952 y 1958. El tiempo de residencia del 36Cl en la atmósfera es de aproximadamente una semana. Así pues, es un marcador para las aguas superficiales y subterráneas de los años 1950, y también es útil para la datación de aguas que tengan menos de 50 años. El 36Cl se ha empleado en otras áreas de las ciencias geológicas, incluyendo la datación de hielo y sedimentos.
Núclido Abundancia Masa Espín Periodo de semidesintegración Producto de desintegración 32Cl - 31,9857 1 298 ms ε 33Cl - 32,9775 3/2 2,51 s ε 34Cl - 33,9738 0 1,53 s ε 35Cl 75,77 34,9689 3/2 - - 36Cl - 35,9683 2 301000 a β- 37Cl 24,23 36,9659 3/2 - - 38Cl - 37,9680 2 37,2 m β- 39Cl - 38,9680 3/2 55,6 m β- 40Cl - 39,9704 2 1,38 m β- 41Cl - 40,9707 n.m. 34 s β- 42Cl - 41,9732 n.m. 6,8 s β- 43Cl - 42,9742 n.m. 3,3 s β-
Aplicaciones y usos
Producción de insumos industriales y para consumo
Purificación y desinfección
El cloro es un químico importante para la purificación del agua (como en plantas de tratamiento de agua), en desinfectantes, y en la lejía. El cloro en agua es más de tres veces más efectivo como agente desinfectante contra Escherichia coli que una concentración equivalente de bromo.
El cloro como antiséptico fue introducido en 1835 por Holmes (en Boston) y 1847 Semmelweis (en Viena). El cloro se emplea como desinfectante en mobiliarios, equipos, instrumental y áreas hospitalarias. El cloro suele ser usado en la forma de ácido hipocloroso para eliminar bacterias, hongos, parásitos y virus en los suministros de agua potable y piscinas públicas.
Bromo.
El bromo y sus compuestos son empleados en la medicina, específicamente el bromuro de potasio, el cual fue empleado en el siglo 19 como anticonvulsivo. En la actualidad es solo utilizado en animales, debido a que causa disfunciones neurológicas en los seres humanos.
El bromo se emplea ampliamente en la elaboración de retardantes de llama. Funciona de la siguiente manera: cuando esta sustancia se quema, el bromo bloquea el fuego del oxígeno produciendo que este se extinga.
El bromuro que se obtiene del calcio, sodio y zinc se emplea para preparar soluciones específicas para la perforación de sal. También en la elaboración de aceites vegetales bromados que se emplean como emulsión en ciertas marcas de bebidas gaseosas.

En menor medida, el bromo se usa en el mantenimiento de piscinas, específicamente en baños termales. Asimismo, en la desinfección de aguas industriales, como antiséptico e insecticida. El bromo para piscinas está alterado de forma tal que no afecte la salud del bañista
En la industria textil es empleado en la fabricación de colorantes para telas.
Un compuesto importante del bromo es el bromuro de etilo, el cual es una sustancia tóxica usada como antidetonante en la gasolina, que al igual que el plomo previene la degradación del motor. La mezcla de plomo (tetraetilplomo) y bromo es sumamente tóxica, ya que genera un compuesto volátil llamado bromuro de plomo, el cual se escapa con los gases quemados hacia el ambiente, contaminándolo. Esta aplicación perdió interés económico desde la década de los años 70, debido a los problemas ambientales que generó.Sin embargo, se ha retomado el uso del bromo en automóviles, pero en este caso en baterías para vehículos eléctricos para ayudar que estos no provoquen ningún tipo de emisiones.
Yodo.
El uso principal que presenta el yodo es en el campo de la medicina. Por ejemplo, las soluciones de yodo- alcohol y complejos de yodo se emplean como antisépticos y desinfectantes. De hecho una gran cantidad de productos de esterilización usados en el cuerpo contienen yodo, ya que es un eficaz limpiador para las heridas. Además es utilizado en forma de tabletas o en estado líquido para purificar el agua.

Por su parte, los isótopos radiactivos del yodo se aprovechan en la medicina nuclear y en otros campos como trazadores.
También es utilizado en la prevención del bocio, que es la inflamación del área de la garganta y la glándula de la tiroides. La insuficiencia de yodo es la causa más frecuente del bocio. El cuerpo requiere de yodo para producir la hormona tiroidea.
Además, el yodo también presenta aplicaciones del tipo no médicas como por ejemplo, en la elaboración de emulsiones fotográficas, preparación de tintes y lámparas halógenas.
Otro uso significativo es para originar la lluvia con la finalidad de obtener mejoras en el campo de la agricultura. Esto se logra utilizando el yoduro de plata dispersado en las nubes.
Ástato.
El ástato tiene 31 isótopos elevadamente inestables, por lo que solo se han podido producir unos pocos microgramos en los laboratorios. Por esta razón, no presenta alguna aplicabilidad comercial, salvo en investigaciones científicas y médicas.
El astato es el elemento químico más raro de la Tierra. En la tabla periódica se representa con el símbolo At y el número atómico 85. Fue descubierto en los años cuarenta por Dale R. Corson, Kenneth Ross MacKenzie y Emilio Segrè, investigadores de la Universidad de California (Berkeley), y fue denominado así debido a que en griego, la palabra astatos significa inestable. Efectivamente, el astato tiene una vida media cortísima, pues presenta un período de semidesintegración de tan solo 7,2 horas.El astato tiene 31 isótopos realmente inestables. En la naturaleza, este elemento químico es rarísimo. De hecho, la cantidad total de astato sobre la corteza terrestre no supera lo 28 gramos. En otras palabras, cinco veces más que una cucharada de harina, o algo menos de tres cucharadas de sal.
Sin embargo, en los laboratorios solo se han podido producir unos pocos microgramos, y debido a la alta radiactividad de este elemento, se requieren precauciones técnicas y de seguridad muy elevadas, para evitar problemas en los investigadores que trabajan con el astato.Según el equipo del CERN, el valor publicado podría ayudar a conocer nuevas aplicaciones de este elemento químico tan raro en nuestro día a día. Un ejemplo podría ser su utilización en radioterapia, ya que investigaciones anteriores apuntaban a sus ventajas en el tratamiento del cáncer (especialmente del isótopo 211-At), debido a sus propiedades. Existe incluso una patente que apunta al uso de liposomas radiactivos, debido a que la desintegración del astato provoca la emisión de partículas alfa, que presentan bajo poder de penetración y alta masa, capacidades que las hacen ideales para atacar las células tumorales una por una.
Tennessine.
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.
Propiedades químicas del Tennessine
Tennessine es el nombre temporal de un elemento químico aún no descubierto y que tiene el símbolo temporal de Ts y el número atómico 117.
El nombre de “Tennessine” se usa como nombre temporal, usado en artículos científicos cuando se quieren referir a la búsqueda del elemento 116; es la forma latina de decir “uno-uno-siete-ium” (“siendo “ium” una terminación estándar para los nombres de los elementos. Tales elementos transuránicos son siempre producidos artificialmente, y normalmente terminan teniendo el nombre de un científico.


Propiedades químicas del Tennessine
Tennessine es el nombre temporal de un elemento químico aún no descubierto y que tiene el símbolo temporal de Ts y el número atómico 117.
El nombre de “Tennessine” se usa como nombre temporal, usado en artículos científicos cuando se quieren referir a la búsqueda del elemento 116; es la forma latina de decir “uno-uno-siete-ium” (“siendo “ium” una terminación estándar para los nombres de los elementos. Tales elementos transuránicos son siempre producidos artificialmente, y normalmente terminan teniendo el nombre de un científico.
Efectos del Tennessine sobre la salud
Al no haber sido descubierto todavía, sus efectos sobre la salud humana no han podido ser estudiados.
Efectos ambientales del Tennessine
Al no haber sido descubierto todavía, sus efectos sobre el medio ambiente no han podido ser
estudiados.
Al no haber sido descubierto todavía, sus efectos sobre el medio ambiente no han podido ser
estudiados.
Propiedades químicas
Los miembros anteriores del grupo 17 comúnmente aceptan otro electrón para lograr la configuración electrónica estable de un gas noble, con ocho electrones en su capa de valencia (regla del octeto). La propensión a captar un electrón disminuye a medida que aumenta el número atómico dentro del grupo, de tal forma que en el hidruro de astato este cede un electrón al hidrógeno en vez de al contrario; el teneso mostraría una predisposición aún mayor a adquirir un estado de oxidación positivo en compuestos, y el estado −1 sería el menos común.
El teneso también puede completar el octeto mediante la formación de un enlace covalente. Por consiguiente, cuando dos átomos de ununseptium se reúnen, se espera que formen una molécula diatómica, como ocurre con los halógenos. Según los cálculos, en la molécula de At2 el enlace sigma formaría un marcado orbital de antienlace, debido al acoplamiento espín-órbita, que causa que los electrones del orbital molecular se alejen de los núcleos de los átomos enlazados y sen concentren en los extremos de la molécula; es probable que el teneso siga la tendencia a adoptar un enlace covalente débil en la molécula diatómicaTs2 y que esta presente un fuerte carácter pi.Para la molécula TsCl, se predice un enlace pi simple.
Aparte del mencionado estado de oxidación −1 inestable, el teneso podría presentar otros tres estados de oxidación: +5, +3 y +1, de los que el último sería el más estable; esto se debe a la estabilidad del orbital 7p1/2, que conlleva a su vez la desestabilización de los tres electrones más externos en el orbital 7p3/2, como ya se ha observado en el astato.
El compuesto de teneso más simple posible es el monohidruro TsH. En este enlace participan un electrón 7p3/2 del teneso y el electrón 1s del hidrógeno, sin participación de los electrones 7p1/2. A causa de la ya mencionada desestabilidad energética de los electrones nivel 7p3/2, este nivel se extiende hacia la periferia del núcleo de tal modo que se calcula que la longitud de la molécula TsH aumentaría en 17 picómetros debido a este efecto. Como los enlaces de electrones p son dos tercios sigma, el enlace es un tercio más débil que en la ausencia la de interacción espín-órbita.
Los miembros anteriores del grupo 17 comúnmente aceptan otro electrón para lograr la configuración electrónica estable de un gas noble, con ocho electrones en su capa de valencia (regla del octeto). La propensión a captar un electrón disminuye a medida que aumenta el número atómico dentro del grupo, de tal forma que en el hidruro de astato este cede un electrón al hidrógeno en vez de al contrario; el teneso mostraría una predisposición aún mayor a adquirir un estado de oxidación positivo en compuestos, y el estado −1 sería el menos común.
El teneso también puede completar el octeto mediante la formación de un enlace covalente. Por consiguiente, cuando dos átomos de ununseptium se reúnen, se espera que formen una molécula diatómica, como ocurre con los halógenos. Según los cálculos, en la molécula de At2 el enlace sigma formaría un marcado orbital de antienlace, debido al acoplamiento espín-órbita, que causa que los electrones del orbital molecular se alejen de los núcleos de los átomos enlazados y sen concentren en los extremos de la molécula; es probable que el teneso siga la tendencia a adoptar un enlace covalente débil en la molécula diatómicaTs2 y que esta presente un fuerte carácter pi.Para la molécula TsCl, se predice un enlace pi simple.
Aparte del mencionado estado de oxidación −1 inestable, el teneso podría presentar otros tres estados de oxidación: +5, +3 y +1, de los que el último sería el más estable; esto se debe a la estabilidad del orbital 7p1/2, que conlleva a su vez la desestabilización de los tres electrones más externos en el orbital 7p3/2, como ya se ha observado en el astato.
El compuesto de teneso más simple posible es el monohidruro TsH. En este enlace participan un electrón 7p3/2 del teneso y el electrón 1s del hidrógeno, sin participación de los electrones 7p1/2. A causa de la ya mencionada desestabilidad energética de los electrones nivel 7p3/2, este nivel se extiende hacia la periferia del núcleo de tal modo que se calcula que la longitud de la molécula TsH aumentaría en 17 picómetros debido a este efecto. Como los enlaces de electrones p son dos tercios sigma, el enlace es un tercio más débil que en la ausencia la de interacción espín-órbita.